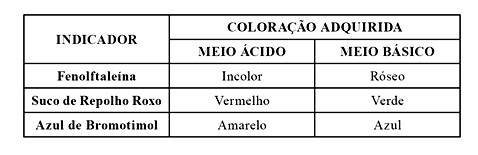
O que é equilíbrio químico
O equilíbrio químico em uma reação química indica que os reagentes e os produtos estão com suas concentrações constantes.
O que é equilíbrio químico
O equilíbrio químico em uma reação química indica que os reagentes e os produtos estão com suas concentrações constantes.
As reações químicas são rearranjos de átomos, onde as quebras das ligações químicas das substâncias dos reagentes irão originar novas ligações, e consequentemente, novas moléculas, formando os produtos.
Assim, em uma reação química os reagentes são consumidos e os produtos são formados. Ou seja, no início da reação existem apenas os reagentes, que irão interagir e originar os produtos.
Reações químicas reversíveis e irreversíveis
As transformações químicas acontecem por meio do aumento ou da diminuição da velocidade de suas reações.
As reações irreversíveis são exemplos de reações em que pelo menos um dos reagentes é totalmente consumido. Como exemplo desse tipo de reação podemos citar o processo de combustão.
Além disso, há também reações que não se completam, ou seja, reações químicas em que o seu rendimento não é 100%. Essas reações químicas são as chamadas reações reversíveis, pois os reagentes formam os produtos e estes voltam a formar os reagentes ao mesmo tempo.
Na maior parte dos processos químicos, as reações químicas ocorrem em dois sentidos, sendo chamados de direto e inverso da reação.
Representando uma reação genérica:
a A + b B ↔ c C + d D
ou
a A + b B ⇋ c C + d D
Esses dois modelos de setas indicam que as reações acima são reversíveis, ou seja, que ocorrem nos dois sentidos da reação. O sentido da esquerda para a direita representa a reação direta, e o sentido da direita para a esquerda representa a reação inversa.
Observação: se as setas apresentam tamanhos diferentes, teremos velocidades diferentes nas reações. Mas, se as setas estão do mesmo tamanho, significa que a reação atingiu o equilíbrio químico.
Equilíbrio químico
Para que ocorra o equilíbrio químico de uma reação, a velocidade direta deve ser igual a velocidade inversa. Além disso, as concentrações dos reagentes e dos produtos se tornam constantes, ou seja, não variam. Também é preciso que as reações sejam reversíveis.
Sendo assim, o equilíbrio químico representa a estabilidade da reação.
A fim de entendermos melhor, vamos pensar em um exemplo. Na reação de formação da amônia temos:
N2 + 3H2 ⇋ 2 NH3
A reação direta representa os dois reagentes formando o produto. Enquanto isso, a reação inversa significa que o produto está formando os dois reagentes novamente.
Durante os processos industriais, ocorre a diminuição da transformação da amônia em N2 e H2, pois o que interessa é apenas a fabricação da amônia.
O equilíbrio químico é um equilíbrio dinâmico, onde a reação não para, continua ocorrendo nos dois sentidos, e as quantidades de reagentes e de produtos ficam inalteradas.
Exemplificando por meio de uma reação genérica:
| A | + | B | ↔ | C | + | D | |
| 10 mol | 10 mol | 0 mol | 0 mol | 0 segundos | |||
| 8 mol | 8 mol | 3 mol | 1 mol | 30 segundos | |||
| 5 mol | 5 mol | 8 mol | 2 mol | 60 segundos | |||
| 5 mol | 5 mol | 8 mol | 2 mol | 90 segundos | |||
| 5 mol | 5 mol | 8 mol | 2 mol | 120 segundos |
Note que no início da reação há somente os reagentes A e B.
Podemos dizer que os reagentes A e B se chocam, reagem entre si, formando os produtos C e D. Estes, ao mesmo tempo, se chocam e reagem, formando novamente A e B, mantendo esse processo constante.
Assim, a reação continua ocorrendo, chegando um momento em que as concentrações são constantes, não mais variam seus valores.
Equilíbrio químico homogêneo e heterogêneo
O equilíbrio químico pode ser homogêneo quando todas as substâncias participantes estão no mesmo estado físico e, geralmente, ocorrem em sistemas gasosos e aquosos. Por exemplo:
H2 (aq) + I2(g) ↔ 2 HI(g)
HCl (aq) ↔ H(aq)+ + Cl(aq)-
Mas o equilíbrio químico pode ser também heterogêneo, quando as substâncias se encontram em estados físicos diferentes e, geralmente, envolvem substâncias sólidas e líquidas. Por exemplo:
Mg (OH)2(s) ↔ Mg(aq)²+ + 2 OH(aq)-
C (s) + O2(g) ↔ 2 CO (g)
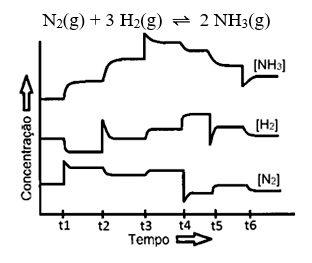
Representações gráficas do equilíbrio químico
Cada equilíbrio químico se comporta de uma maneira diferente por meio de representações gráficas que relacionam suas concentrações com o tempo.
No gráfico abaixo, que relaciona a concentração com o tempo, observamos que ocorrem mais produtos do que reagentes, sendo uma reação mais fácil de acontecer.

Enquanto isso, no segundo gráfico, observamos que as concentrações dos produtos e dos reagentes são constantes.

Por fim, no terceiro gráfico, observamos que as concentrações dos reagentes são maiores que as concentrações dos produtos.

O tempo de equilíbrio representa o momento em que a reação entra em equilíbrio.
Para entendermos a interpretação dos gráficos, devemos compreender que os reagentes estão localizados sempre em cima, pois são consumidos quando a reação começa. Enquanto isso, os produtos ficam embaixo, pois no começo da reação eles não existem.
Uma reação se encontra em equilíbrio químico quando a velocidade da reação direta (no sentido de formação dos produtos) é igual à velocidade da reação inversa (no sentido de formação dos reagentes). Para sabermos quantitativamente se uma reação na qual se estabelece um equilíbrio molecular tende para a formação de produtos ou para a formação de reagentes, definimos uma constante de equilíbrio, K, que só depende da temperatura.
Constante de equilíbrio
A constante de equilíbrio K pode ser calculada em termos de M ou concentração em quantidade de matéria, Kc, ou em termos de pressão parcial, Kp, conforme a fase de agregação das substâncias participantes.
Considere a reação em seguida:
a A + b B ⇆ c C + d D
a) Reação direta e expressão da velocidade:
a A + b B → c C + d D
Velocidade direta = K direta . [A]a . [B]b
b) Reação inversa e expressão da velocidade:
c C + d D → a A + b B
Velocidade inversa = K inversa . [C]c . [D]d
No equilíbrio temos: V direta = V inversa, então:
K (direta) . [A]a . [B]b = K (inversa) . [C]c . [D]d
Assim teremos:

A constante de equilíbrio em termos de concentração em quantidade de matéria, Kc, é igual ao quociente entre o K direto e o K inverso.

Cada concentração é elevada ao expoente igual ao respectivo coeficiente de cada substância na equação química.
Na expressão de Kc só devem ser expressas as concentrações de componentes gasosos e em solução aquosa, que são concentrações que sofrem variações. Os sólidos e líquidos puros não são escritos, pois eles possuem concentração constante.
Quando há pelo menos um dos componentes da reação no estado gasoso, a constante de equilíbrio também pode ser expressa em termos de pressão, sendo representada por Kp.
a A + b B ↔ c C + d D

As expressões de Kc e Kp foram determinadas pela relação:

Como exemplo temos:
I) CaCO3(s) ↔ CaO(s) + CO2(g)
Kc = [CO2]¹
II) Zn(s) + 2 HCl(aq) ↔ ZnCl2(aq) + H2(g)
Podemos citar como exemplo de equilíbrio químico uma garrafa de água com gás ou refrigerante fechado. No refrigerante, ocorre reação de equilíbrio químico entre o CO2 com água e formação de ácido carbônico (H2CO3), que se decompõe em CO2 e H2O novamente.
H2CO3(aq) ↔ H2O + CO2(aq)
Assim, quando abrimos a garrafa, sua pressão interna diminui liberando o gás.
Videoaula
Por fim, assista a esta videoaula do nosso canal do YouTube com o prof. Sobis:
Exercícios:
.