Cinética química – Simulado de Química
Veja o que sabe sobre cinética química com o Simulado Enem que preparamos para você mandar bem na hora da prova. São apenas 10 questões para você estudar!
Você sabe o que é cinética química? Esse é um assunto comum no Enem em questões envolvendo a disciplina da química, então confira uma aula em vídeo para entender melhor o conteúdo:
Muito bem! Agora faça o simulado com calma e atenção que os exercícios lhe ajudarão em seus estudos.
Cinética química – Simulado de Química
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(UDESC SC/2017)
A cinética química é a área da química que trata das velocidades das reações.
Analise os processos em relação à cinética química.
I. Quando o carvão está iniciando a sua queima, as pessoas ventilam o sistema para que a queima se propague mais rapidamente.
II. Um comprimido efervescente se dissolve mais rapidamente quando triturado.Assinale a alternativa que contém os fatores que influenciam as velocidades das reações químicas nos processos descritos em I e II, respectivamente.
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 2 de 10
2. Pergunta
(UDESC SC/2016)
Cinética química é a parte da Química que estuda a velocidade das reações, a influência das concentrações de produtos e os reagentes na velocidade, assim como a influência de outros fatores, como temperatura, presença de catalisador, inibidor, etc. Em termodinâmica estuda-se o equilíbrio entre espécies químicas em uma reação, assim como fatores que influenciam o deslocamento desse equilíbrio, que podem ser variados de forma a maximizar ou minimizar a obtenção de um determinado composto.
Sobre essas duas importantes áreas da Química, analise as proposições.
I. A influência da concentração dos reagentes sobre a velocidade de uma reação é dada pela sua lei de velocidade, que é uma expressão matemática que sempre envolve a concentração de todos os reagentes, cada um elevado ao seu coeficiente estequiométrico.
II. A posição de um dado equilíbrio químico – o lado para o qual ele se encontra majoritariamente deslocado – pode ser deduzida a partir da lei de velocidade para qualquer equilíbrio químico.
III. Reações lentas são reações necessariamente deslocadas para os reagentes. Já reações rápidas se processam com consumo total dos reagentes e de maneira quase imediata.
IV. À pressão constante, o aumento da temperatura tem sempre uma influência de aumentar a velocidade de uma reação, mas o efeito desse aumento sobre o deslocamento do equilíbrio depende, primordialmente, da variação de entalpia para a reação na faixa de temperatura avaliada.
V. Tempo de meia vida é o tempo necessário para que a concentração de um reagente caia a metade de seu valor inicial, correspondendo ao tempo de equilíbrio da reação, que é definido como o tempo necessário para que metade dos produtos se transforme em reagente.Assinale a alternativa correta.
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 3 de 10
3. Pergunta
(IFPE/2015)
A cinética química é parte da química que estuda a velocidade ou rapidez das reações químicas e, se controlarmos algumas delas, podemos tirar proveito de seus efeitos, por exemplo, se você deixa o leite líquido fora da geladeira, em algumas horas ele pode ficar azedo e, no entanto, se colocado na geladeira, pode durar dias. Já para cozinhar os alimentos, utilizamos a panela de pressão porque nela podemos atingir temperaturas maiores que 100ºC, acelerando o cozimento. Para fazer com que as reações ocorram mais rapidamente, utilizam-se os catalisadores, que são substâncias aceleradoras da velocidade das reações, mas não são por elas consumidas. Analise as afirmações abaixo em relação aos catalisadores.
I. Os catalisadores aceleram a velocidade das reações químicas porque diminuem a energia de ativação.
II. Os catalisadores aumentam a massa do produto obtido na reação.
III. Os catalisadores transformam uma reação direta em uma reação inversa.
IV. Os catalisadores aumentam as quantidades de calor liberados ou absorvidos nos processos químicos.
V. Luz e calor também são considerados catalisadores, pois aceleram a velocidade das reaçõesÉ(São) verdadeira(s):
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 4 de 10
4. Pergunta
(FCM PB/2015)
Conhecer os fundamentos teóricos da cinética química é de grande importância, principalmente para as indústrias químicas. Afinal, acelerando-se as reações, reduz-se o tempo gasto com a produção, tornando os processos químicos mais econômicos e os produtos finais mais competitivos no mercado. Com relação à cinética das reações, considere o mecanismo abaixo da reação de decomposição do peróxido de hidrogênio em presença de íons iodeto.
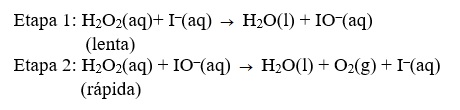
Com base no mecanismo, assinale a alternativa correta.
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 5 de 10
5. Pergunta
(UNCISAL/2014)
A Cinética Química estuda a velocidade das reações químicas e os fatores que a influenciam. A velocidade de uma reação é determinada por meio de leis deduzidas a partir da concentração de reagentes e produtos formados.
Considere as seguintes afirmações sobre estudos cinéticos de uma reação química e assinale a correta.
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 6 de 10
6. Pergunta
(UDESC SC/2012)
A cinética química e a parte da química que trata das velocidades das reações. Macroscopicamente, os resultados de estudos cinéticos permitem a modelagem de sistemas complexos, tais como processos que ocorrem na atmosfera ou até mesmo no corpo humano. O estudo de catalisadores, que são cruciais para a indústria química e para o desenvolvimento de novos combustíveis, também é um ramo da cinética química.Sobre esse tema, leia atentamente as proposições abaixo.
I. A energia de ativação de uma reação é uma medida da energia cinética mínima necessária às espécies, para que reajam quando elas colidirem.
II. Em uma reação que ocorre em múltiplas etapas, as etapas que ocorrem mais rapidamente serão determinantes para a velocidade da reação global.
III. Um catalisador é uma substância que modifica o mecanismo de reação, provendo uma rota alternativa com energia de ativação drasticamente aumentada para a reação, o que diminui assim a velocidade da reação.
IV. Uma reação ocorre geralmente como resultado de uma série de etapas chamadas de reações elementares. Numa reação elementar, a molecularidade é definida pelo número de partículas (moléculas, átomos ou íons) de reagente envolvidas em uma reação elementar.
V. A constante de velocidade de uma reação pode ser obtida pela medida da constante de equilíbrio da reação. A relação entre as constantes de equilíbrio da reação direta e inversa, quando estas são iguais, fornece o valor da constante de velocidade.Assinale a alternativa correta.
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 7 de 10
7. Pergunta
(Fac. Israelita de C. da Saúde Albert Einstein SP/2018)
Para que uma reação química aconteça, as moléculas dos reagentes devem colidir com geometria favorável e devem possuir energia suficiente. Se essas duas condições forem atingidas ocorrerá a formação do complexo ativado, o qual corresponde a um estado de transição. Existem vários fatores que influenciam na rapidez das reações, por exemplo, a superfície de contato e a temperatura.
O gráfico mostra a variação da energia cinética das moléculas em baixa e alta temperatura. Sobre a influência do aumento da temperatura para a formação do complexo ativado e na rapidez das reações químicas foram feitas as afirmações abaixoI. Com o aumento da temperatura, um maior número de moléculas irá possuir energia suficiente para atingir o estado de ativação.
II. O aumento da temperatura aumenta o número de colisões entre as moléculas dos reagentes e, consequentemente, aumentam os choques não eficazes e os eficazes.
III. Para que ocorra a formação do complexo ativado, as moléculas dos reagentes devem possuir uma quantidade de energia no mínimo igual à energia de ativação e, portanto, o aumento de temperatura favorece a formação do complexo ativado.
IV. A formação do complexo ativado ocorre apenas em reações endotérmicas.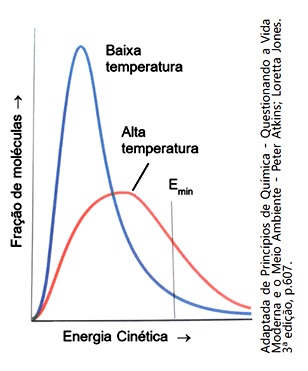
As afirmativas corretas são:
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 8 de 10
8. Pergunta
(UNIRG TO/2018)
Para armazenar alimentos em conserva, são utilizadas latas metálicas seladas, fabricadas com um material chamado folha de flandres. Trata-se de uma chapa de aço revestida com uma fina camada de estanho, metal brilhante, que apresenta elevado potencial de oxidação, superior ao do ferro, presente no aço da lata. Pode-se ainda revestir a superfície interna com uma camada de verniz à base de epóxi, ou aumentar a espessura da camada de estanho. Recomenda-se não comprar uma lata de conserva amassada, porque o amassado pode:
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 9 de 10
9. Pergunta
(Mackenzie SP/2018)
 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 10 de 10
10. Pergunta
(UEA AM/2017)
 Correto
CorretoParabéns! Siga para a próxima questão.
Sobre o(a) autor(a):
Taynara Macedo -
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


