Números quânticos e a hibridização
Hibridização de orbitais parece um nome complexo, mas você vai ver nessa aula como os conceitos são simples! Venha estudar com a gente para a Química do Enem e dos vestibulares!
Vamos relembrar alguns conceitos para estudar a hibridização. O átomo é formado por 2 regiões distintas: núcleo e eletrosfera. Por sua vez, a eletrosfera é formada por camadas (níveis de energia) e subcamadas (subníveis de energia). Cada elétron está distribuído em uma camada específica e ocupa também uma região específica (orbital).
O que é hibridização?
Algumas vezes o átomo não consegue realizar 2, 3 ou 4 ligações e para que estas ocorram, os orbitais se misturam conferindo estabilidade ao elemento químico, através do processo denominado hibridização.
A eletrosfera é formada por 7 camadas ou níveis de energia, que são representados pelas letras: K, L, M, N, O, P, Q. Além desses níveis, a eletrosfera também conta com os subníveis de energia, divididos em s, p, d, f.
Cada subnível comporta uma quantidade máxima de elétrons onde: o subnível s possui 2 elétrons, o subnível p possui 6 elétrons, o subnível d possui 10 elétrons e o subnível f possui 14 elétrons.
Por meio do Diagrama de Linus Pauling realizamos a distribuição dos elétrons nos níveis e subníveis de energia, de maneira crescente de energia, para identificar a camada de valência.
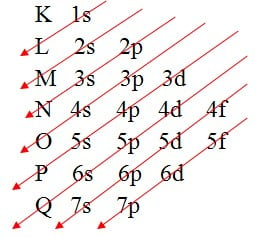
O modelo atômico atual é resultado de inúmeros estudos e pesquisas ao longo de milhares de anos, onde sabemos que os elétrons giram ao redor do núcleo, com trajetórias indeterminadas.
Os números quânticos
E para saber onde eles se encontram exatamente (em qual nível, subnível ou orbital) foram criados os números quânticos, representados por 4 números relacionados com a identificação e localização dos elétrons no átomo.
O número quântico principal é representado pela letra N e indica a camada onde o átomo se encontra. Cada camada recebe uma numeração que varia de 1 até 7.
| K | L | M | N | O | P | Q |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
O número quântico secundário ou azimutal é representado pela letra L e indica o subnível de energia onde o elétron se encontra. Cada subnível é representado por um número, começando do zero. Assim, temos:
| s | p | d | f | |
| l | 0 | 1 | 2 | 3 |
O número de elétrons que cada subnível comporta é referente ao número máximo de elétrons desse subnível. Em cada orbital (região de maior probabilidade para se encontrar os elétrons) existem no máximo 2 elétrons, que giram em sentidos contrários (horário e anti-horário).
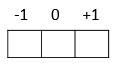
O número quântico magnético (m) indica em qual região (orbital) o elétron se encontra.
Vamos assistir uma aula de número quântico para tirar as dúvidas:
Como representar o orbital?
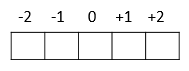
Cada orbital é representado por um quadrado. Apresenta variação de -l a +l.
Cada subnível possui uma quantidade de orbitais de acordo com a quantidade de elétrons que cada subnível comporta. Assim, o subnível s possui 1 orbital, o subnível p possui 3 orbitais, o subnível d possui 5 orbitais e o subnível f possui 7 orbitais, como mostrado no esquema:
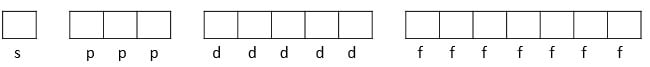
O subnível s apresenta apenas 1 orbital, formado por 2 elétrons. Apresenta formato esférico.

m = 0:
![]()
O subnível p apresenta 3 orbitais (Px, Py, Pz) com no máximo 6 elétrons. Apresenta forma de haltere ou ampulheta. Onde m varia de: (m = -1 até +1)
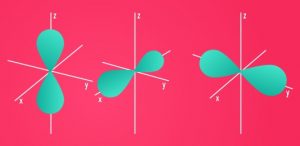
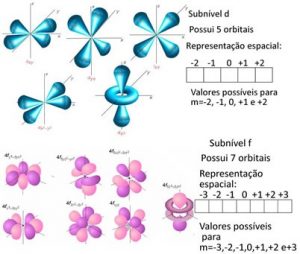
O subnível d apresenta 5 orbitais com no máximo 10 elétrons, onde m = -2 até +2.
O subnível f apresenta 7 orbitais com no máximo 14 elétrons, onde m = -3 até +3.
O número quântico spin
O último número quântico é o spin (s) que indica o sentido da rotação do elétron em sentidos contrários (horário e anti-horário), formando um campo magnético de atração para compensar a repulsão entre eles. O spin pode ser +½ ou -½.
Cada orbital atômico deve ser preenchido com no máximo 2 elétrons, com seus spins em sentidos opostos, emparelhados. Os elétrons desemparelhados são elétrons que se encontram sozinhos em um orbital.
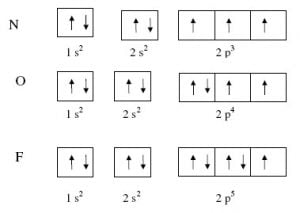
A distribuição dos elétrons nos orbitais segue uma regra específica, onde cada orbital recebe 1 elétron apenas. O segundo elétron será distribuído depois que todos os orbitais daquele subnível já estiverem com o primeiro elétron preenchido. Vamos ver alguns exemplos?
A hibridização
Os átomos, para realizarem as ligações, necessitam de elétrons desemparelhados. Nem sempre, para fazer a distribuição eletrônica do elemento, o número de elétrons desemparelhados na última camada representa o número de elétrons necessários para realizar a ligação.
Nesse caso, os átomos sofrem o processo de hibridização, que é a mistura de orbitais diferentes. Essa mistura gera novos orbitais híbridos.
A hibridização justifica o número de ligações que o átomo realiza, conferindo estabilidade ao elemento químico. Assim, um orbital incompleto ou desemparelhado indica a quantidade de ligações que o átomo é capaz de realizar.
Vamos entender como isso acontece?
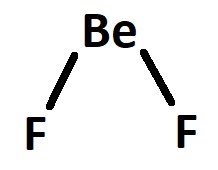
No composto: BeF2: o flúor realiza 1 ligação e o berílio realiza 2 ligações iguais.
Vamos fazer a distribuição eletrônica dos elementos:
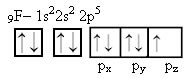
Primeiro devemos preencher os subníveis iniciais com os 2 elétrons correspondentes, em seguida passar ao outro orbital. No orbital p encontramos 5 elétrons, devemos preencher primeiro com 1 elétron cada orbital, depois com os elétrons restantes.
Podemos observar que 1 orbital p (o pz) está semi-preenchido, ou seja, é o que representa a ligação que o flúor é capaz de fazer.
O átomo de berílio apresenta a seguinte distribuição:
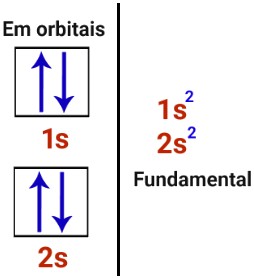
Pelo citado acima podemos observar que o berílio está totalmente preenchido, e assim, não realiza mais nenhuma ligação, pois não há orbital semi-preenchido sobrando em sua distribuição.
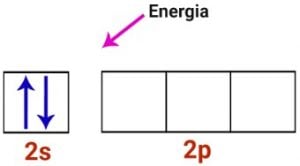
Mas sabemos que o berílio realiza 2 ligações, então temos que abrir um orbital p para que ocorra o desemparelhamento dos elétrons do orbital s.
Assim, no estado excitado, ocorre migração de elétrons para camadas mais energéticas. Neste caso, há migração de elétrons do orbital s para o orbital p, que irão se misturar.
Importante:
Para ocorrer a hibridização, o átomo precisa receber energia para excitar os elétrons da camada de valência.
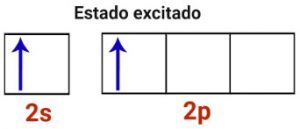
Podemos observar que ocorrem agora 2 orbitais semi-preenchidos e 2 orbitais p puros, que não participam da ligação.
No estado hibridizado há união dos orbitais s e p, formando uma hibridação do tipo sp.
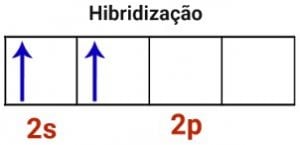
Podemos representar a estrutura da ligação como:
Vamos ver mais um exemplo?
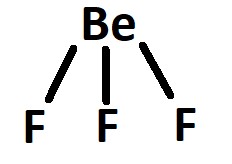
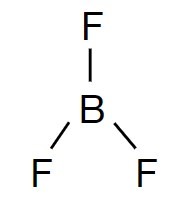
No composto: BF3: sabemos que o flúor realiza uma ligação apenas, e o boro realiza 3 ligações iguais.
Já realizamos a distribuição do flúor e verificamos que ele realmente faz 1 ligação.
Agora vamos fazer a distribuição eletrônica do boro:
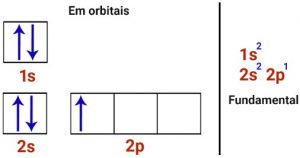
Conforme observado acima, percebemos que o boro somente consegue realizar uma ligação, pois somente apresenta 1 elétron semi-preenchido. Mas, na realidade, ele precisa fazer 3 ligações, então 1 elétron do orbital s migra para o orbital p.
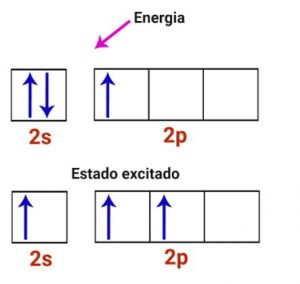
Podemos verificar acima que temos 3 orbitais semi-preenchidos, onde irão ocorrer as ligações e 1 orbital p puro, que não participa da ligação. Este tipo de hibridação é do tipo sp², pois 1 orbital s se mistura com 2 orbitais p.
A representação da estrutura da ligação do composto é:
Para determinar a hibridização de um átomo em uma molécula, devemos analisar este átomo e contar o total de pares de elétrons ligantes e não ligantes ao redor deste átomo.
Não podemos esquecer que a ligação covalente é igual a 1 par de elétrons, assim como as ligações duplas e triplas também.
Então para simplificar nossa aula:
Para determinarmos a hibridização de qualquer átomo, devemos contar a quantidade de ligações sigma (simples ligações) e o número de pares de elétrons livres no átomo que será estudado.
Caso a soma dê como resultado o número 2, teremos uma hibridação sp; quando a soma for igual 3, teremos uma hibridação sp²; soma igual a 4, teremos uma hibridação igual a sp³; soma igual a 5, teremos uma hibridação sp³d e soma igual a 6, teremos uma hibridação igual a sp³d².
Agora vamos fazer a representação de outras hibridações:
a) hibridação sp (2 ligações sigmas)
![]()
b) sp² (3 ligações sigmas)
c) sp³ (3 ligações sigmas + par de elétron)
Videoaula
Aprenda mais sobre Hibridização com nossa videoaula exclusiva. Nesta aula, o professor Sobis te explica o que é hibridização com exemplos que vão te ajudar a compreender esse assunto.
Exercícios
(UEPI)
Sobre o elemento químico vanádio, de número atômico 23, são feitas as seguintes afirmações:
I. A camada de valência do vanádio possui três (3) elétrons;
II. Possui onze (11) elétrons na terceira camada eletrônica;
III. Os quatro números quânticos para os elétrons da última camada são: 3 ; 2 ; 0 ; + 1/2;
IV. A camada de valência do vanádio possui dois (2) elétrons.
Indique a alternativa correta:
a) somente as afirmações II e IV estão corretas.
b) somente as afirmações I e II estão corretas.
c) somente as afirmações III e IV estão corretas.
d) somente as afirmações I e III estão corretas.
e) somente as afirmações I e IV estão corretas.
gabarito: A
resolução: possui 11 elétrons na terceira camada: 1 s² 2 s² 2 p6 3 s² 3 p6 4 s² 3 d³.
2) (Ufac)
Um elétron localiza-se na camada “2” e subnível “p” quando apresenta os seguintes valores de números quânticos:
a) n = 4 e l = 0
b) n = 2 e l = 1
c) n = 2 e l = 2
d) n = 3 e l = 1
e) n = 2 e l = 0
gabarito: B
3) (UFT)
Quais são os quatro números quânticos principal(n), azimutal (l), magnético (ml) e de momento angular orbital (ms), para a configuração 4p²?
a) n = 4; l = 0; ml = 0; ms = –1/2
b) n = 4; l = 0; ml = –1; ms = –1/2
c) n = 4; l = 1; ml = –1; ms = +1/2
d) n = 4; l = 1; ml = 0; Ms = +1/2
Gabarito: D
4) UFPA)
Os números quântico principal “n”, secundário “l”, magnético “m” do elétron mais energético do átomo de cloro são respectivamente:
(Dado Cl: Z=17)
a) 3, 1, 0;
b) 3, 1, +1;
c) 2, 0, +1;
d) 2, 1, -1;
e) 2, 3, 0;
gabarito: A





