Constantes de equilíbrio Kc e Kp
Quando uma reação está em equilíbrio, a reação direta e a reação inversa contam com a mesma velocidade. As concentrações dos componentes da reação permanecem constantes no equilíbrio, embora as reações direta e inversa ainda estejam ocorrendo. Venha aumentar seus conhecimentos e estudar conosco para a prova do Enem!
Entenda a Constante de Equilíbrio: Uma reação se encontra em equilíbrio químico quando a velocidade da reação direta (no sentido de formação dos produtos) é igual a velocidade da reação inversa (no sentido de formação dos reagentes).
Para sabermos, quantitativamente, se uma reação na qual se estabelece um equilíbrio molecular tende para a formação de produtos ou para a formação de reagentes, definimos uma constante de equilíbrio, K, que só depende da temperatura.
A constante de equilíbrio K pode ser calculada em termos de M ou concentração em quantidade de matéria, Kc, ou em termos de pressão parcial, Kp, conforme a fase de agregação das substâncias participantes.
Constantes de Equilíbrio Kc e Kp
Veja agora uma introdução à Constante de Equilíbrio com a professora de Química Larissa Campos, do canal do Curso Enem Gratuito.
Valeu pra você o resumo inicial? Acompanhe agora o raciocínio paa as Constantes de Equilíbrio Kc e Kp.
Considere a reação:
aA + bB ⇆ cC + dD
a) Reação direta e expressão da velocidade:
aA + bB → cC + dD
Velocidade direta = Kdireta . [A]a . [B]b
b) Reação inversa e expressão da velocidade:
cC + dD → aA + bB
Velocidade inversa = Kinversa . [C]c . [D]d
No equilíbrio temos: V direta = V inversa, então:
K(direta) . [A]a . [B]b = K(inversa) . [C]c . [Dd
Assim teremos:

A constante de equilíbrio em termos de concentração em quantidade de matéria, Kc, é igual ao quociente entre o K direto e o K inverso.
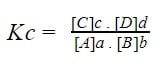
Cada concentração é elevada ao expoente igual ao respectivo coeficiente de cada substância na equação química.
Na expressão de Kc só devem ser expressas as concentrações de componentes gasosos e em solução aquosa, que são concentrações que sofrem variações. Os sólidos e líquidos puros não são escritos, pois eles possuem concentração constante.
Como exemplo temos:
I) CaCO3(s) ↔ CaO(s) + CO2(g)
Kc = [CO2]¹
II) Zn(s) + 2 HCl(aq) ↔ ZnCl2(aq) + H2(g)
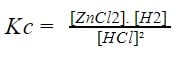
Quando há pelo menos um dos componentes da reação no estado gasoso, a constante de equilíbrio também pode ser expressa em termos de pressão, sendo representada por Kp.
aA + bB ↔ cC + dD
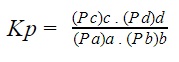
Como exemplo podemos citar:
I) CO2(g) + H2(g) ↔ CO(g) + H2O (l)
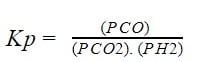
II) CaCO3(s) ↔ CaO(s) + CO2(g)
Kp = (PCO2)
Em relação às constantes de equilíbrio Kc e Kp devemos observar:
a) só devem fazer parte da expressão de Kc as concentrações em quantidade de matéria que podem sofrer variações, como o caso de substâncias em solução (na fase líquida) ou de substâncias na fase gasosa.
b) na expressão de Kp entram apenas as substâncias que se encontram na fase gasosa, pois a pressão parcial de sólidos e líquidos é desprezível.
c) a constante de equilíbrio é característica de cada reação e também da temperatura, ou seja, o valor de Kc ou Kp, para uma mesma reação, só irá variar se a temperatura variar.
As expressões de Kc e Kp forma determinadas pela relação:
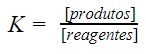
De acordo com o valor numérico de Kc ou Kp de uma reação, observamos que:
a) Um valor alto de Kc ou Kp indica que a quantidade de produtos é alta em relação à quantidade de reagentes. Assim, o equilíbrio tende para a direita, no sentido de formação dos produtos.
b) Um valor baixo de Kc ou Kp indica que a quantidade de reagentes é alta em relação à quantidade de produtos. Assim, o equilíbrio tende para a esquerda, no sentido de formação dos reagentes.
c) Se em uma reação reversível ocorrer Kc = 1 ou Kp = 1, a certa temperatura, conclui-se que nessa temperatura, a concentração em quantidade de matéria ou a pressão parcial de reagentes e produtos é a mesma. Assim, a reação não irá tender nem para a direita nem para a esquerda.
Podemos relacionar Kc e Kp por meio da seguinte equação:
Kp = Kc . (R . T). Δn onde:
Kp = constante de equilíbrio em função das pressões parciais
Kc = constante de equilíbrio em função das concentrações
R = constante dos gases e usamos : 0,082 atm.l/mol.K quando a pressão parcial é expressa em atm
T = temperatura em Kelvin (ºC + 273 )
Δn = variação do número de mols (mol dos produtos – mol dos reagentes)
Grau de Equilíbrio
O grau de equilíbrio (alfa) representa o rendimento de uma reação química por meio da relação entre o reagente e a quantidade de mols desse reagente.
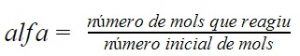
Quanto maior for o grau de equilíbrio, maior a chance da reação atingir o equilíbrio.
Exemplos de exercícios
1) Dada a equação química: A + B ↔ C
A reação inicia com 100 mols de A. Se, ao chegarmos ao equilíbrio, ainda houver 20 mols de A sem reagir, qual o grau de equilíbrio da reação?
Resolução: ainda há 20 mols de A; portanto a quantidade que reagiu foi de 80 mols.
alfa= 80 dividido por 100 = 80%
2) (PUC-SP) No equilíbrio: N2(g) + 3 H2(g) ↔ 2 NH3(g). Verifica-se que Kc = 2,4 x 10³– ( mol/L)²– a 727ºC. Qual o valor de Kp, nas mesmas condições físicas; R = 8,2 x 10²– atm.L.K¹–.mol¹–
T = ºC + 273
T = 727 + 273 = 1000K
Δn = 2 – (1+ 3)
Δn = 2 – 4 = -2
Kp = Kc . (R.T) . Δn
Kp = 2,4 x 10³– . ( 8,2 x 10²– . 1000 )²–
Kp = 3,57 x 10-7
Reações reversíveis
Quando determinadas substâncias reagem entre si, elas o fazem sempre em quantidades estequiométricas definidas, proporcionais aos coeficientes da equação química balanceada.
Uma reação reversível ocorre quando apenas uma parte da quantidade inicial de reagentes se transforma em certa quantidade de produtos. Essas quantidades permanecem constantes a partir do momento em que o equilíbrio químico foi estabelecido à temperatura T.
A diferença entre a quantidade inicial de substâncias reagentes e a quantidade que efetivamente se transformou em produtos é aquela que fica em equilíbrio na temperatura T.
É importante observar que a quantidade de reagentes e a quantidade de produtos que permanecem em equilíbrio geralmente não se encontram em proporção estequiométrica.
A partir da quantidade de reagentes que restou em equilíbrio e da quantidade de produtos formados que é feito o cálculo das constantes de equilíbrio Kc ou Kp, na temperatura T.
Produto e Solubilidade
E para saber mais sobre produto de solubilidade, assista nossa aula:
Exercícios sobre Constante de Equilíbrio
1) (PUC-RS-2009)
Dada a expressão da constante de equilíbrio em termos de concentração de produtos e reagentes é:
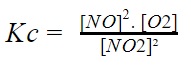
A equação química que pode ser representada por essa expressão é:
a) 2 NO2(g) ↔ 2 NO(g) + O2(g)
b) 2 NO(g) + O2(g) ↔ 2 NO2(g)
c) NO2(g) ↔ 2 NO(g) + O2(g)
d) 2 NO2(g) ↔ NO(g) + O(g)
e) NO(g) + O2(g) ↔ 2 NO2(g)
2) (VUNESP-SP-2010)
Em determinadas condições de pressão e temperatura, há 0,5 mol/L de N2O4 em equilíbrio com 2 mol/L de NO2.
N2O4(g) ↔ 2 NO2(g)
Calcular o valor de Kp a 27ºc:
a) 186,5
b) 188,4
c) 196,8
d) 196,0
e) 150,0
3) (UFCE-CE-2010)
Considerando um reservatório mantido à temperatura constante, tem-se estabelecido o equilíbrio químico como na equação:
PCl5(g) ↔ PCl3(g) + Cl2(g)
Sendo que as pressões parciais no equilíbrio são: PCl5 = 0,15 atm; PCl3 = 0,30 atm e PCl2 = 0,10 atm. Assinale a alternativa correta para o valor de Kp da reação:
a) 0,05 atm
b) 0,10 atm
c) 0,15 atm
d) 0,20 atm
e) 0,25 atm
4) (UNB-2011)
O pentacloreto de fósforo é um reagente muito importante em química orgânica. Ele é preparado em fase aquosa pela reação:
1 PCl3(g) + 1 Cl2(g) ↔ 1 PCL5(g)
Um frasco de 3 litros contém as seguintes quantidades de equilíbrio a 200ºC: 0,120 mol/L de PCl5; 0,600 mol/L de PCl3 e 0,0120 mol/L de Cl2. O valor da constante de equilíbrio, em mol/L, nessa temperatura:
a) 20
b) 50
c) 75
d) 100
e) 125
5) (CESGRANRIO-2010)
Em um recipiente de 5 litros, a uma temperatura T, são misturados 5 mol de CO e 5 mol de H2O. Quando o equilíbrio é atingido, coexistem 3,325 mol de CO2 e 3,325 mol de H2. Calcular o valor de Kc, na temperatura T, para o seguinte equilíbrio:
CO(g) + H2O(g) ↔ CO2(g) + H2(g)
a) 3940
b) 394
c) 0,394
d) 39,4
e) 3,94
Gabarito:
- A
- D
- B
- B
- E





