Energia de ativação e a Lei de Ação das Massas
Você sabia que a cinética química está presente em nosso dia a dia através da identificação dos fatores que irão influenciar a velocidade das reações químicas, aumentando ou diminuindo sua rapidez? Então venha estudar conosco e se preparar para a prova do Enem!
Quando colocamos os alimentos dentro da geladeira ou do freezer, estamos diminuindo a temperatura na qual estes alimentos estão expostos. A gente acaba fazendo isso no automático, mas nosso intuito é evitar a deterioração dos alimentos. Por isso, nessa aula vamos entender as reações elementares, o que é energia de ativação e a velocidade da reação!
Além dos processos já falados, existem outros bem comuns da nossa rotina que mostram a importância da temperatura e da energia utilizada nas reações. Em outro processo, quando estamos cozinhando os alimentos, aumentamos a chama do fogão para aumentar a temperatura de cozimento dos alimentos e, assim, agilizar todo o processo.
Quando fazemos churrasco com carvão, por exemplo, é comum no início da queima que as pessoas abanem o fogo para que a chama se propague mais rápido. Pode não parecer, mas você está fazendo um processo químico! Esses processos também ocorrem em nosso organismo.
Muitas reações químicas são realizadas por catalisadores. As enzimas, que favorecem reações de quebras e digestão dos alimentos, são exemplos de catalisadores. Já nas indústrias, os catalisadores são importantes para o desenvolvimento mais rápido das reações químicas.
Conseguiu verificar como a Química está presente em nosso cotidiano por diversos processos e maneiras? Agora vamos ver um pouquinho da teoria.
Reações elementares e cinética química
Na Química, o termo velocidade está relacionado ao quanto uma reação química se desenvolve mais rapidamente ou mais lentamente. A cinética química estuda a velocidade das reações químicas (rapidez com que os reagentes são consumidos ou a rapidez com que os produtos são formados) e os fatores que a influenciam.
Tem-se a seguinte reação hipotética:
aA + bB → cC + dD
Primeiramente, há apenas as substâncias A e B (reagentes que vão sendo consumidos e diminuindo progressivamente). Em seguida, começam a se formar as substâncias C e D, que vão aumentando até que a reação se complete.
A velocidade média (Vm), calculada em função de uma das substâncias participantes da reação, é a razão entre a quantidade consumida ou produzida da substância e o intervalo de tempo (Δt) em que isso ocorreu:
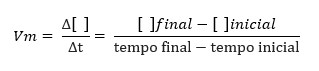
A velocidade média da reação é o valor da velocidade de consumo de um dos reagentes, ou da velocidade de formação de um dos produtos, dividido pelo respectivo coeficiente da substância na equação da reação balanceada.
Como exemplo temos a seguinte reação:
N2(g) + 3 H2(g) ↔ 2NH3 (g)
| Tempo | Reagente 1 | Reagente 2 | Produto |
| T0 = 0 | 10 mol | 15 mol | 0 |
| T1 = 1seg | 9 mol | 12 mol | 2 mol |
| T2 = 2seg | 7 mol | 6 mol | 6 mol |
| T3 = 3seg | 7 mol | 6 mol | 6 mol |
Vamos calcular a velocidade média de N2, NH3 e H2 no intervalo To – T2:
VN2 =  = – 1,5 mol/seg (isso significa que ele está sendo consumido)
= – 1,5 mol/seg (isso significa que ele está sendo consumido)
VNH3 = 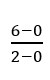 = 3 mol/seg (está sendo produzido)
= 3 mol/seg (está sendo produzido)
VH2 = 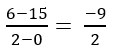 = – 4,5 mol/seg
= – 4,5 mol/seg
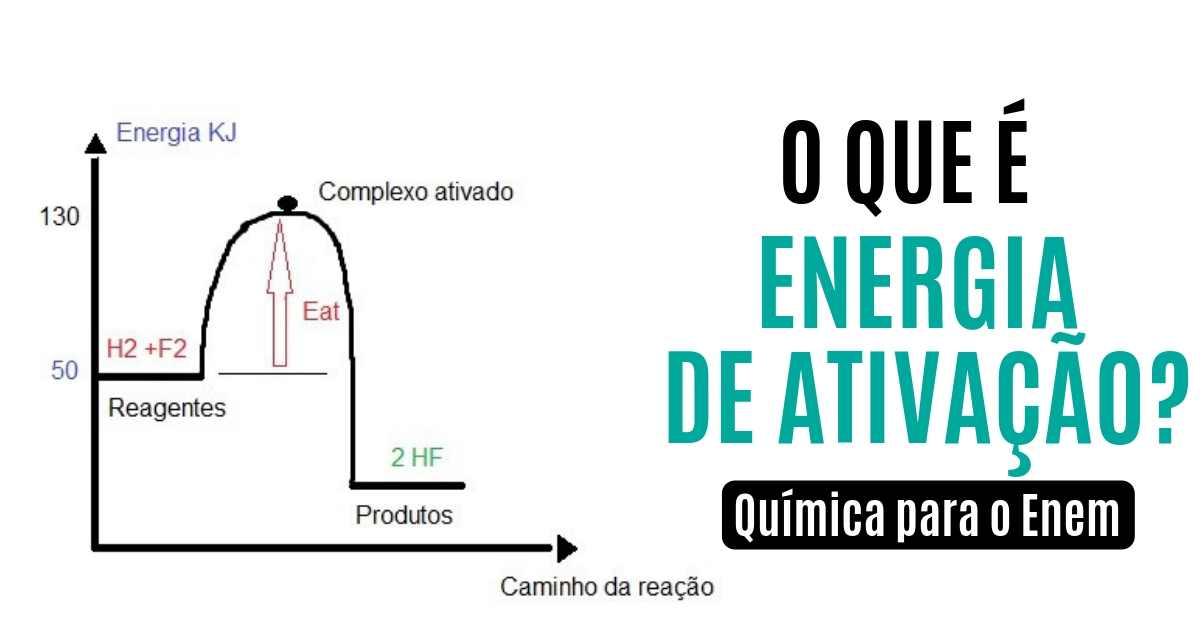
O que é energia de ativação
Para que uma reação química ocorra, os reagentes devem entrar em contato e devem ter afinidade química. As moléculas dos reagentes devem colidir entre si com energia suficiente para romper as ligações existentes nos reagentes.
Para que a colisão ocorra, é preciso que os reagentes adquiram uma quantidade mínima de energia chamada de energia de ativação. Para que a chama do fogão seja formada, por exemplo, é preciso fornecer uma faísca elétrica para permitir a ocorrência da reação entre o gás oxigênio e o gás de cozinha.
Quando a energia de colisão entre as partículas dos reagentes é igual ou superior à energia de ativação, forma-se uma estrutura instável e intermediária entre os reagentes e produtos denominada de complexo ativado (estado transitório da reação entre os reagentes, enquanto os produtos ainda não foram formados).
Complexo ativado das reações elementares
Quanto mais o complexo ativado demorar para ser formado, maior será a energia de ativação utilizada pelos reagentes, e menor será a velocidade de reação. Por isso, as reações químicas mais rápidas são aquelas em que a energia de ativação usada pelos reagentes é menor, o que resulta em uma formação mais rápida do complexo ativado.
No gráfico abaixo, podemos calcular a energia de ativação através do seguinte cálculo: subtrair a energia do complexo ativado pela energia dos reagentes:
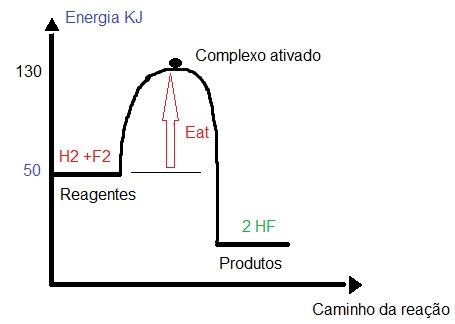
Calculando a energia de ativação:
Eat = 130-50
Eat = 80 kj
Independentemente de a reação química ser exotérmica ou endotérmica, os reagentes sempre irão necessitar de uma energia de ativação para atingir o complexo ativado. A energia de ativação varia de acordo com o tipo de reação química: nas reações endotérmicas ela é maior do que nas reações exotérmicas.
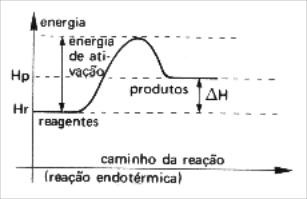
ΔH > 0
Hp > Hr
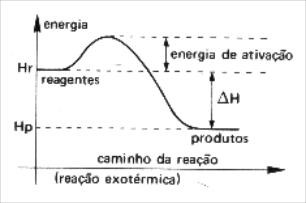
ΔH < 0
Hp < Hr
A energia de ativação representa um obstáculo na transformação de reagentes em produtos. A reação só ocorre se esse obstáculo for transposto, isto é, se as moléculas dos reagentes adquirirem energia de ativação.
Assim, quanto menor for a energia de ativação a ser adquirida, mais facilmente os reagentes irão transpor esse obstáculo, e mais rapidamente a reação irá ocorrer. Em contrapartida, quanto maior for a energia de ativação a ser adquirida, mais difícil será para os reagentes transpor esse obstáculo, e a reação ocorrerá mais lentamente.
Fatores que alteram a velocidade das reações
As reações químicas ocorrem com velocidades diferentes e estas podem ser alteradas, porque além da concentração de reagentes e produtos, as velocidades das reações dependem de outros fatores como a luz e a eletricidade. Por exemplo, quanto maior o fornecimento de luz e eletricidade, maior será a velocidade das reações que são ativadas por esses fatores.
Pressão e concentração de reagentes
A pressão também influencia a velocidade de uma reação, pois quanto maior a pressão em sistemas em que ocorrem reações na fase gasosa, maior o contato entre as partículas reagentes e, com isso, maior a velocidade da reação. A concentração de reagentes também influencia a velocidade de uma reação, pois quanto maior o número de partículas de reagente por unidade de volume, maior a possibilidade de haver colisão entre essas partículas, e assim, maior a velocidade da reação.
Temperatura
Outro fator que interfere na velocidade das reações é a temperatura. Por ser diretamente proporcional ao movimento das partículas de uma substância, um aumento de temperatura implica um aumento do movimento das partículas, aumentando assim os choques entre elas. Esse acúmulo de choques provoca o aumento da velocidade da reação.
Catalisador
A adição de catalisador é uma substância que adicionada à reação aumenta a velocidade da mesma. O catalisador age diminuindo a energia de ativação, mas não alterando o ΔH. Mas esse catalisador não é consumido durante a reação química. Assim, se o exercício te perguntar quem foi o catalisador na reação, é só buscar aquela substância que não foi consumida.
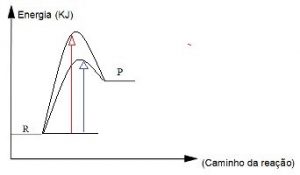
Quando uma reação química processa-se com a utilização de um catalisador, observa-se uma segunda curva abaixo da curva maior, indicando que a energia de ativação sofreu uma diminuição. Isso significa que a formação do complexo ativado foi mais rápida, tornando a reação também mais rápida.
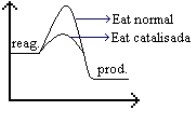
No gráfico abaixo observamos que a seta azul indica uma energia de ativação menor, com presença de catalisador, que se processa de forma mais rápida, e a seta vermelha indica uma energia de ativação maior.
Lei da Ação das Massas
Dois químicos noruegueses, Cato Maximilian Guldeberg (1836 – 1902) e Peter Waage (1833 – 1900), estudando a cinética das reações químicas em função da concentração dos reagentes, estabeleceram por volta de 1864 a Lei de Ação das Massas, cujo enunciado é:
A cada temperatura, a velocidade de uma reação é diretamente proporcional ao produto das concentrações em quantidade de matéria dos reagentes, elevadas a expoentes determinados experimentalmente.
Considerar a seguinte reação hipotética:
aA + bB → cC + dD
V = k. [A]x . [ B ]y
v = velocidade da reação
k = constante de velocidade
[A] = concentração molar de A
[B] = concentração molar de B
x e y = expoentes determinados experimentalmente
Quando uma reação química se desenvolve em uma única etapa, recebe a denominação de reação elementar. Numa reação elementar, os expoentes a que se devem ser elevadas as concentrações em quantidade de matéria dos reagentes na expressão da velocidade são os próprios coeficientes dos reagentes da equação balanceada.
aA + bB → cC + dD
Ordem de uma reação é a soma de todos os expoentes que aparecem na expressão da velocidade da reação.
V = k. [A]a . [B]b
ou como no exemplo:
2 CO(g) + 1 O2(g) → 2 CO2(g)
V = k . [CO]2 . [O2]1
ordem da reação = 2 + 1 = 3 (3ª ordem)
Quando a reação se desenvolve em duas ou mais etapas distintas, esta reação chama-se não elementar. A velocidade dessa reação depende apenas da velocidade da etapa lenta. A velocidade da reação global será proporcional apenas às concentrações em quantidade de matéria dos reagentes que participam da etapa lenta.
Exemplo
Temos como exemplo:
etapa 1(lenta): C(graft) + ½ O2(g) → CO(g)
etapa 2 (rápida): CO(g) + ½ O2(g) → CO2(g)
etapa global: C(graft) + O2(g) → CO2(g)
velocidade da reação: V = k. [C]1 . [O2]½
Podemos determinar experimentalmente a ordem de uma reação e consequentemente os expoentes que entram na expressão da velocidade, observando como a variação na concentração de um dos reagentes altera a velocidade da reação.
Então vamos ver como isto será feito a partir de uma reação genérica:
N2(g) + 3 H2(g) → 2 NH3(g)
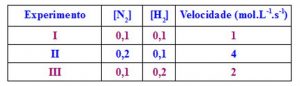
Na tabela acima há 3 experimentos que representam as etapas da reação, as concentrações e as velocidades de cada etapa.
Como não é uma reação elementar, onde os coeficientes são os expoentes, e também não é reação não elementar, onde iremos trabalhar com a reação lenta, devemos escolher dois experimentos: primeiramente verificamos onde a concentração de N2 varia, e onde a concentração de H2 se mantém constante. Assim, do experimento I para o experimento II, a concentração de N2 dobrou, enquanto que a velocidade quadruplicou, e H2 se manteve igual. Assim temos:
2x = 4
2x = 2²
X = 2
Agora observamos a concentração de H2: no experimento I e III, a concentração de H2 mudou e a concentração de N2 não mudou. Do experimento I para o III, a concentração de H2 dobrou e a velocidade também. Assim temos:
2x = 2, logo x = 1 (reagente H2 de 1º ordem)
A expressão da velocidade é igual a:
V = k. [N2]2 . [H2]1
Videoaula
Depois de tanta informação vamos ver as aulas e compreender melhor este conteúdo?
Exercícios sobre energia de ativação
Por fim, vamos testar nossos conhecimentos em alguns exercícios:
1) (UFMG-MG-2009)
A elevação da temperatura aumenta a velocidade das reações químicas porque aumenta os fatores apresentados nas alternativas, exceto:
a) a energia cinética média das moléculas
b) a energia de ativação
c) a frequência das colisões efetivas
d) o número de colisões por segundo entre as moléculas
e) a velocidade média das moléculas
2) (UNESP-SP)
Sobre catalisadores, são feitas quatro afirmações:
I- são substâncias que aumentam a velocidade de uma reação
II- reduzem a energia de ativação da reação
III- as reações nas quais atuam não ocorreriam nas suas ausências
IV- enzimas são catalisadores biológicos
Dentre estas afirmações, estão corretas, apenas:
a) I e II
b) II e III
c) I, II e III
d) I, II e IV
e) II, III e IV
3) (VUNESP-SP-2012)
Uma certa reação química, representada pela equação abaixo:
A + 4B → X + Y
É formada após a ocorrência de 3 etapas, as quais estão representadas a seguir:
reação I: A + 2B → C + D (reação lenta)
reação II: C + B → X
reação III: D + B → Y (reação rápida)
Qual das alternativas abaixo contêm a expressão da velocidade para essa reação genérica?
a) V = k. [A]2 . [B]1
b) V = k . [A]1 . [B]2
c) V = k . [A]1 . [B]1
d) V = k . [B]2
4) (UERN-RN)
No estudo cinético da reação representada por: x + y → z, foram encontradas as seguintes variações de concentração e velocidade em um intervalo de tempo:
Analisando os resultados, a expressão correta da lei da velocidade para essa reação é:
a) V = k . [x]2 . [y]2
b) V = k . [x]3 . [y]3
c) V = k . [x]3 . [y]2
d) V = k . [x]2 . [y]3
Gabarito:
- B
- D
- B
- D