Resumo com Simulado de Equilíbrio Químico
Veja o que sabe sobre equilíbrio químico com o simulado de química do Curso Enem Gratuito. São apenas 10 questões para você estudar, com dicas para garantir o acerto na hora da prova.
Veja agora no resumo com simulado de Equilíbrio Químico os fundamentos que você precisa para gabaritar nas questões do Enem e do Vestibular.
O Equilíbrio Químico em uma reação química indica que os reagentes e os produtos estão com suas concentrações constantes. Aprenda de maneira bem rápida e fácil com o professor Felipe Sobis, do canal do Curso Enem Gratuito.
O que é o Equilíbrio Químico
Aprenda a resolver questões de Equilíbrio Químico
Veja agora com a professora Larissa Marques, do canal do Curso Enem Gratuito, como você faz para resolver as questões com três níveis de dificuldade: Fácil; Médio, e Difícil.
Aprendeu as dicas para resolver as questões de química que caem nas provas? Se precisar, veja novamente como foi que a professora Larissa resolveu estas questões.
Simulado de Equilíbrio Químico
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(UECE/2017)
Um estudante de química retirou água do seguinte sistema em equilíbrio:
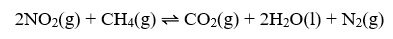
Em seguida, esse aluno constatou acertadamente que
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 2 de 10
2. Pergunta
(FATEC SP/2017)
O gás amônia se dissolve em água segundo a reação em equilíbrio
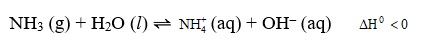
Segundo a teoria proposta por Arrhenius, a solução aquosa resultante da dissolução da amônia em água é classificada como
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 3 de 10
3. Pergunta
(PUC SP/2017)
Uma das reações utilizadas para a demonstração de deslocamento de equilíbrio, devido à mudança de cor, é a representada pela equação a seguir:
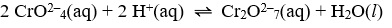
sendo que, o cromato (CrO2–4) possui cor amarela e o dicromato (Cr2O2–7) possui cor alaranjada.
Sobre esse equilíbrio foram feitas as seguintes afirmações:
I. A adição de HCl provoca o deslocamento do equilíbrio para a direita.
II. A adição de NaOH resulta na cor alaranjada da solução.
III.A adição de HCl provoca o efeito do íon comum.
IV. A adição de dicromato de potássio não desloca o equilíbrio.
As afirmações corretas são:
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 4 de 10
4. Pergunta
(UFJF MG/2017)
Segundo o princípio de Le Châtelier, se um sistema em equilíbrio é submetido a qualquer perturbação externa, o equilíbrio é deslocado no sentido contrário a esta perturbação. Assim, conforme o sistema se ajusta, a posição do equilíbrio se desloca favorecendo a formação de mais produtos ou reagentes. A figura abaixo mostra diferentes variações no equilíbrio da reação de produção de amônia de acordo com a perturbação que ocorre. Em quais tempos verifica-se um efeito que desloca o equilíbrio favorecendo os reagentes?
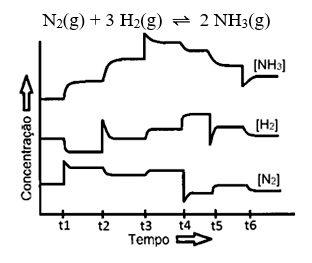 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 5 de 10
5. Pergunta
(FAMERP SP/2016)
 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 6 de 10
6. Pergunta
(USF SP/2016)
 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 7 de 10
7. Pergunta
(Unimontes MG/2015)
 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 8 de 10
8. Pergunta
(FUVEST SP/2018)
 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 9 de 10
9. Pergunta
(UNIRG TO/2018)
O odor característico de peixe se deve a substâncias orgânicas que apresentam caráter básico e pertencem à função química amina. Para amenizar esse odor, observe os materiais disponíveis no quadro a seguir e assinale a única alternativa correta.
Obs: desconsidere qualquer caráter corrosivo dos materiais apresentados. Considere apenas os valores de pH para soluções aquosas dos referidos materiais.
 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 10 de 10
10. Pergunta
(Mackenzie SP/2018)
Indicadores são substâncias que mudam de cor na presença de íons H+ e OH– livres em uma solução. Justamente por esta propriedade, são usados para indicar o pH, ou seja, os indicadores “indicam” se uma solução é ácida ou básica. Esses indicadores podem ser substâncias sintéticas como a fenolftaleína e o azul de bromotimol, ou substâncias que encontramos em nosso cotidiano, como por exemplo, o suco de repolho roxo, que apresenta uma determinada coloração em meio ácido e uma outra coloração em meio básico. A tabela a seguir ilustra as cores características dessas substâncias nos intervalos ácido e básico.
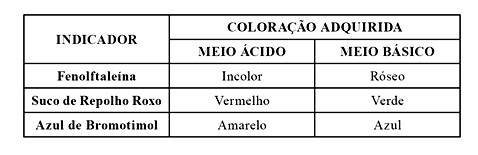
Assim, um estudante preparou três soluções aquosas concentradas de diferentes substâncias, de acordo com a ilustração abaixo.
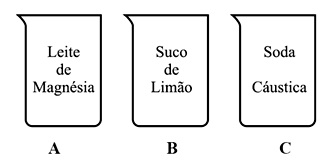
Após o preparo, o estudante adicionou ao recipiente A (fenolftaleína), ao B (suco de repolho roxo) e ao C (azul de bromotimol). Sendo assim, as cores obtidas, respectivamente, nos recipientes A, B e C, foram
CorretoParabéns! Siga para a próxima questão.
.
=
Tá difícil ainda para resolver os exercícios de Equilíbrio Químico?
Pra tudo tem jeito. Confira aqui um resumo completo, teoria e prática, para você dominar geral Equilíbrio Químico.
Sobre o(a) autor(a):
Taynara Macedo -
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


