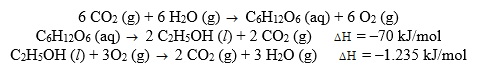Introdução à termoquímica
A Termoquímica pode ser explicada como sendo a variação de calor que ocorre nas reações químicas.
Nesta aula de Química você vai aprender o que é termoquímica e como o conhecimento sobre essa área se desenvolveu ao longo do tempo. Também vai estudar o que é entalpia e como ocorrem as reações químicas endotérmicas e exotérmicas.
O que é termoquímica
Primeiramente, a termoquímica representa o estudo das trocas de energia na forma de calor ao longo dos fenômenos físicos e químicos. Sendo que essa energia pode ser absorvida ou liberada na forma de calor durante as reações químicas.
História da termoquímica
Em toda a História da humanidade, o fogo e a propagação do calor sempre estiveram presentes no desenvolvimento e na descoberta de novas invenções. Os gregos na antiguidade, por exemplo, já se preocupavam com os efeitos do calor e da temperatura.
Ao longo do tempo, muitos foram os cientistas que estudaram o fenômeno da combustão e também da transferência de calor. Veja alguns deles:
- Robert Boyle (1627-1691)
A partir de seus experimentos afirmava que os metais quando aquecidos aumentavam suas massas. Assim, o calórico era considerado uma matéria que compunha o fogo e o ar, e que o aumento de sua massa era devido a transferência do calórico para o metal.
- Joseph Black (1728-1799)
Em 1757 iniciou os estudos sobre calor e posteriormente verificou que é necessário fornecer calor para que as mudanças de estado físico ocorram. Além disso, Black também acreditava que existia um fluido chamado calórico, que era considerado como matéria. Esse seria transferido de um corpo para outro.
- Lavoisier (1743-1794)
Lavoisier evidencia que o calor não pode ser criado ou destruído, mas move-se de um corpo para outro.
No século XVIII, as máquinas a vapor são desenvolvidas por James Watt (1736 – 1819), onde seu funcionamento relacionava calor e trabalho.
- Benjamin Thompson (1753 – 1814)
Em 1798, Thompson realiza um experimento em uma fábrica em Munique, onde verifica a produção de calor por atrito. Seu experimento baseava-se em montar peças metálicas umas sobre as outras. Peças essas que estavam mergulhadas em um recipiente contendo água sob aquecimento.
Através desse experimento, Thompson verificou a elevação da temperatura da água, e que esta, ao entrar em ebulição, sua massa não sofria alteração. Assim, para Thompson, o calor era de origem atribuída ao movimento das partículas dos materiais que estavam sob atrito.
- Friedrich Mohr (1806 – 1879)
Em 1837, pesquisando todos esses experimentos, verificou que há uma força (energia) sob determinadas condições, que pode ser resultado do movimento das suas partículas, da sua coesão, luz e calor. Assim, concluiu que o calor não é um tipo particular de matéria, mas um movimento oscilatório de pequenas partes dos corpos. Surgindo com isso o conceito de calor como energia em trânsito.
Introdução à termoquímica
Veja agora com o professor Felipe Sobis, do canal do Curso Enem Gratuito, um resumo esperto para você compreender os fundamentos da Termoquímica:
Energia, temperatura e calor
Após esse longo caminho através dos séculos, os cientistas conseguiram estabelecer alguns conceitos básicos da termoquímica, como os conceitos de energia, temperatura e calor.
Sendo assim, atualmente a energia pode ser entendida como a capacidade de um corpo ou substância de transformar calor ou realizar um certo trabalho.
Já a temperatura é tida como uma grandeza que depende da energia de agitação das partículas que compõem as substâncias. Assim, podemos verificar que quanto maior a temperatura, maior será a agitação (energia) das moléculas.
Por fim, o calor representa uma energia em movimento, e este se propaga da substância com temperatura maior para a substância de temperatura menor.
Calor latente e entalpia
Na Física, temos o calor latente, referente às mudanças de estado físico, e o calor sensível, referente às mudanças de temperatura. O calor é representado por meio da letra Q, sendo sua unidade em Joule (J) ou caloria (cal).
Onde temos que: 1 cal = 4,18J
Na Química, o calor envolvido nas reações químicas é a entalpia, sendo representado pela letra H. Sua unidade trabalhada é o Joule (J) ou caloria (cal).
É importante ressaltar que não é possível calcular o valor da entalpia. Dessa maneira, devemos calcular a sua variação, que é representada pelo símbolo ∆H, onde este é equivalente à: variação final – variação inicial.
Dessa forma, temos que o calor representa a energia absorvida ou liberada pela reação química.
Resumo sobre entalpia
Confira agora um resumo sobre entalpia, para você nunca mais esquecer:
Calor e reações químicas
As reações químicas ocorrem em todos os momentos de nossas vidas, seja quando vamos cozinhar um alimento, durante a produção de energia pelo nosso organismo, durante os processos de mudanças de estado físico da matéria, etc
Em todos esses processos citados acima, ocorre absorção ou liberação de energia para o ambiente.
De antemão, precisamos lembrar que as substâncias são formadas por grande quantidade de energia em sua composição. Isso é resultado das ligações entre seus átomos, de suas forças intermoleculares e da movimentação de suas partículas.
Uma reação química representa um rearranjo dos átomos, formando assim novas moléculas. Assim, na reação para que possamos romper uma ligação, devemos fornecer energia.
Portanto, para formar uma nova ligação química, devemos liberar energia.
Reações químicas
Primeiramente, vamos recordar como representar as reações químicas. Teremos os reagentes, localizados antes da seta, e os produtos, localizados depois da seta. Por exemplo:
A + B → C + D
Onde A e B são os reagentes da reação, e C e D são os produtos da reação.
Este processo ocorre por causa das quebras das ligações entre os átomos que formam as substâncias. Assim, estes se reorganizam em novas ligações químicas, formando novas substâncias que irão reagir com a energia da matéria.
Afinal, o que é a termoquímica e o que ela tem a ver com isso? Ela pode ser explicada como sendo a variação de calor que ocorre nas reações químicas.
Para quantificar sua energia na forma de calor dentro das reações químicas, é usado a entalpia, representada pela letra H. A entalpia representa a energia presente nas substâncias, e que pode ser alterada pelas reações químicas.
Dessa maneira, os processos químicos que liberam calor são denominados de exotérmicos. Já os processos que absorvem calor, que será incorporado para que a reação química ocorra, são denominados de endotérmicos.
Reação endotérmica e exotérmica
Quando temos uma panela com água fervendo, esse fenômeno caracteriza a ebulição, onde temos um fenômeno físico. Nesse caso, não ocorre alteração da estrutura molecular da água, sendo um processo endotérmico, pois a água absorve calor.
Na queima do etanol, no processo de combustão, ocorre um fenômeno químico. Nesse processo há alteração da estrutura molecular do álcool, com um rearranjo de seus átomos, sendo um processo exotérmico, que libera calor.
Mudanças de estados físicos são endotérmicas ou exotérmicas?
Quando tiramos o gelo do congelador e ele derrete, temos a fusão, que representa um fenômeno físico. Nele, acontece absorção de calor do ambiente, sendo assim um processo endotérmico.
Em contrapartida, quando estamos no carro com os vidros fechados, estes logo começam a embaçar. Esse fenômeno é conhecido como condensação, um processo físico. Nesse sentido o vapor d’água troca calor com o vidro do carro, sendo um processo exotérmico.
Além disso, podemos citar as mudanças de estado físico, onde para uma substância passar de um estado para outro, suas moléculas devem ser reorganizadas, com a necessidade de absorção ou liberação de calor para o ambiente.

Processos endotérmicos
Pelo esquema acima, das mudanças de estado físico, podemos observar que há aumento de energia durante as passagens dos estados: S → L → G. Dessa maneira entendemos que essas mudanças são um processo endotérmico, pois as substâncias nesses estados físicos absorvem calor para que a reação ocorra.
Processos exotérmicos
Durante as passagens dos estados: G → L → S, ocorre diminuição de energia. Portanto, vemos que essas mudanças são um processo exotérmico, pois as substâncias nesses estados físicos liberam calor para que a reação ocorra.
Energia das reações químicas
A energia das reações químicas é medida através da entalpia (H). A variação da entalpia representa o calor absorvido ou liberado nas reações químicas a uma certa pressão constante.
Vimos que a variação da entalpia é: entalpia final – entalpia inicial. Assim, podemos escrever que em uma reação química, a variação de entalpia é representada por:
∆H = Hf – Hi
(Hf =entalpia final e Hi = entalpia inicial)
∆H = Hp – Hr
(Hp = entalpia dos produtos e Hr= entalpia dos reagentes)
Em uma reação química quando a energia presente nos reagentes for menor que a energia dos produtos, deverá ocorrer absorção de energia para que a reação possa acontecer. Nesse caso teremos uma reação endotérmica, e seu ∆H será maior que zero. (∆H >0).
Já em uma reação química quando a energia presente nos reagentes for maior que a energia dos produtos, ocorre uma sobra de energia na reação, que será liberada na forma de calor. Nesse caso teremos uma reação exotérmica, e seu (∆H será menor que zero. (∆H <0).
Além das reações, os processos endotérmicos e exotérmicos podem ser representados por meio de gráficos que relacionam a entalpia com o caminho da reação.
As reações endotérmicas absorvem calor e seu ∆H é maior do que zero, logo teremos: Hp > Hr.
Representações das reações endotérmicas
Pode ocorrer dois tipos de representações das reações endotérmicas:
A + B → C ∆H = 53,5 kcal
A + B + 53,5 kcal → C2H2(g)
Observamos que o calor faz parte dos reagentes.
Vamos agora representar através de um gráfico uma reação endotérmica, que absorve calor.

No gráfico acima podemos observar que a energia se desloca no sentido de formação dos produtos. Assim, vemos que a energia dos reagentes é menor do que a energia dos produtos. Dessa maneira temos que a variação de entalpia é positiva.
Representações das reações exotérmicas
As reações exotérmicas liberam calor para o meio, sendo seu ∆H menor do que zero, logo: Hp < Hr.
Podemos representá-las através de dois esquemas:
A + B → C ∆H = – 900 kj/mol
A + B → C + 900 kj/mol
Observamos nessa reação que o calor está presente nos produtos.
Agora representamos uma reação exotérmica através de um gráfico:

No gráfico acima podemos observar que a entalpia dos produtos é menor do que a entalpia dos reagentes, por isso a variação de entalpia é negativa.
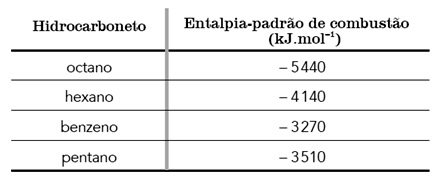
Exercícios sobre termoquímica
.