Ph e POh na Solução-tampão: o efeito do íon comum
Solução tampão é aquela que praticamente não sofre variação de pH ou de pOH pela adição de pequenas quantidades de ácidos fortes ou de bases fortes.
Antes de entender o que é e como funciona a solução-tampão, precisamos entender o que é o efeito do íon comum. Vamos começar relembrando o Princípio de Le Chatelier, que afirma que quando se aplica uma força sobre um certo equilíbrio químico, a sua tendência é se reajustar.
Esse reajuste após a modificação do estado anterior ocorre para minimizar os efeitos da força, ou seja, o sistema tentará voltar para a situação inicial de equilíbrio.
Efeito do íon comum
A adição de um íon que seja comum a um sistema em equilíbrio causará um deslocamento de equilíbrio. Isso irá diminuir a concentração em quantidade de matéria do íon em questão. Esse fenômeno é conhecido como efeito do íon comum.
Esse efeito pode ser utilizado para diminuir o grau de ionização de um ácido ou de dissociação de uma base. O efeito do íon comum ocorre em três diferentes situações: as que envolvem ácido fraco, base fraca e sais.
O que é pH? O que é pOH?
Antes de prosseguir no resumo da Solução-tampão veja um resumo sobre Ácidos e Bases com o professor de química Felipe Sobis, do canal do Curso Enem Gratuito. Ele vai ensinar você o que é o Ph, e o que é o pOh de uma solução.
Exemplos do efeito do Íon
Vamos ver alguns exemplos?
Tem-se uma solução aquosa de um ácido genérico qualquer em equilíbrio:
HA ↔ H+ + A-
HA(aq) + H2O(l) ↔ H3O+(aq) + A-(aq)
A sua constante pode ser expressa por:
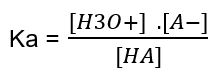
Adicionando à solução aquosa deste ácido um sal CA(s) que possua em comum com o ácido HA(aq) o mesmo ânion A-(aq), irá ocorrer, segundo o Princípio de Le Chatelier, um deslocamento do equilíbrio no sentido de diminuir a ionização do ácido HA(aq).
CA(s) ⥂(H2O) C+(aq) + A-(aq)
↑ [A-] : HA(aq) + H2O ⥄ H3O+(aq) + A-(aq)
Desse modo, o valor de Ka permanece constante desde que a temperatura também permaneça constante. Isso ocorre porque à medida que a concentração de ânions A-(aq) aumenta pela adição do sal CA(aq), a concentração de moléculas HA(aq) aumenta pelo deslocamento do equilíbrio.
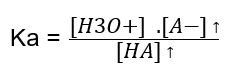
Agora vamos ver outro exemplo. Tem-se uma solução aquosa de uma base genérica COH(s) em equilíbrio, cujo Kb pode ser expresso por:
COH(s) ↔(H2O) C+(aq) + OH-(aq)
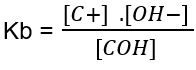
Adicionando-se à solução aquosa dessa base um sal CA(s) que possua em comum com a base COH(aq) o mesmo cátion C+(aq), irá ocorrer um deslocamento do equilíbrio no sentido de diminuir a dissociação da base COH(aq).
CA(s) ⥂ (H2O) C+(aq) + A-(aq)
↑ [C+]: COH(aq) ⥄(H2O) C+(aq) + OH-(aq)
Desse modo, o valor de Kb permanece constante desde que a temperatura também permaneça constante. O princípio é o mesmo que falamos ali em cima: à medida que a concentração de cátions C+(aq) aumenta pela adição do sal CA(aq), a concentração de COH(aq) aumenta pelo deslocamento do equilíbrio:
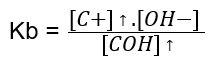
Chegou a hora de ver o que acontece com os sais. Tem-se o seguinte equilíbrio:
AgCl(s) ↔ Ag+(aq) + Cl-(aq)
Adicionando à solução um sal que apresenta um íon comum, como o NaCl, o deslocamento de equilíbrio ocorre para a esquerda, provocando uma maior precipitação de AgCl(s) e diminuindo a solubilidade da solução. Assim, a adição de um íon comum diminui a solubilidade de um composto iônico.
O efeito do íon comum é responsável pela capacidade que as soluções tampão possuem de quase não sofrer variação de pH ou pOH com a adição de pequenas quantidades de ácidos fortes ou bases fortes em seu meio. Vamos entender o que é solução-tampão?
Solução-tampão
Uma solução-tampão pode ser formada por um ácido de natureza fraca e por um sal formado da reação entre esse ácido e uma base forte (ou seja, um sal de base forte). A solução-tampão também pode ser formada por base fraca e por um ácido formado pela reação dessa base com um ácido forte (sal de ácido forte).
Na química, falamos que a natureza dessa solução é tamponada. A preparação dela pode ser feita apenas pela dissolução dos produtos em água. Assim, podemos definir solução tampão como a solução que praticamente não sofre variação de pH ou de pOH pela adição de pequenas quantidades de ácidos fortes ou de bases fortes.
Introdução à Solução-Tampão
Confira agora com a professora Larissa Campos, do canal do Curso Enem Gratuito, um resumo sobre o que é uma solução-tampão, e como ela funciona. Aprenda ainda como ela é essencial para o funcionamento do corpo humano.
Tipos de soluções-tampão
Há dois tipos de soluções-tampão: as constituídas por um ácido fraco e um sal solúvel de mesmo ânion que esse ácido e as constituídas por uma base fraca e um sal solúvel de mesmo cátion que essa base.
Exemplos
Vamos aos exemplos?
Temos uma solução-tampão formada de ácido cianídrico (ácido fraco) e cianeto de sódio (sal solúvel):
HCN(aq) e NaCN(s) ⇒ ânion comum: cianeto (CN-)
I) Na solução-tampão formam-se dois equilíbrios:
a) ionização do ácido fraco (pequena):
HCN(l) + H2O(l) ⥄ H3O+(aq) + CN-(aq)
b) dissociação do sal (grande):
NaCN(l) ⥂ (H2O) Na+(aq) + CN-(aq)
O ânion cianeto do sal (ânion comum) faz com que o 1º equilíbrio se torne mais deslocado no sentido de diminuir a ionização do ácido.
Ao adicionar uma base forte à solução-tampão, por exemplo o KOH(aq), irá ocorrer a dissociação da base:
KOH(s) ⥂ (H2O) K+(aq) + OH-(aq)
Os íons OH-(aq) da base são neutralizados pelos íons H3O+(aq) do 1º equilíbrio.
OH-(aq) + H3O+(aq) ⥂ 2 H2O(l)
Diminuindo a concentração de íons H3O+ no equilíbrio, haverá um deslocamento no sentido de aumentar a ionização do ácido e, desse modo, a variação de pH da solução será muito pequena, pois a concentração de íons H3O+ em solução permanece constante.
A adição sucessiva de pequenas quantidades de base forte irá deslocar o 1º equilíbrio continuamente no sentido da ionização do ácido fraco e, em determinado instante, todo o ácido terá sido ionizado. Nesse momento, cessa o chamado efeito tampão.
Com a adição de um ácido forte à solução-tampão, por exemplo o HCl, irá ocorrer a ionização do ácido:
HCl(aq) + H2O(l) ⥂ H3O+(aq) + Cl-(aq)
Como o ácido acético é um ácido fraco, concluímos que o ânion acetato possui grande afinidade pelo próton H+ do íon hidrônio H3O+. Na solução, há grande quantidade de ânions acetato liberados pelo sal (acetato de sódio) no 2º equilíbrio. Assim, ocorre a seguinte reação:
CN-(aq) + H3O+(aq) ⥂ HCN(aq) + H2O(l)
O aumento dos íons H3O+ em solução provoca um aumento proporcional de moléculas de ácido acético, e assim a variação de pH será muito pequena.
A adição sucessiva de pequenas quantidades de ácido forte acabará em certo instante consumindo todo o ânion acetato fornecido pela dissociação do sal no 2º equilíbrio. Nesse momento, cessa o efeito tampão da solução.
II) Temos uma solução-tampão formada de hidróxido de amônio (NH4OH), que é uma base fraca, e de cloreto de amônio (NH4Cl), que é um sal solúvel.
NH4OH(aq) e NH4Cl(s) ⇨ cátion comum: amônio (NH4+).
Na solução-tampão formam-se dois equilíbrios:
a) dissociação da base fraca:
NH4OH(aq) ⥄ (H2O) NH4+(aq) + OH-(aq)
b) dissociação do sal:
NH4Cl(s) ⥂ (H2O) NH4+(aq) + Cl-(aq)
Ao adicionar uma base forte à solução-tampão, por exemplo, o KOH, irá ocorrer a dissociação da base forte:
KOH(s) + H2O(l) ⥂ K+(aq) + OH-(aq)
O hidróxido de amônio é uma base fraca, então concluímos que o cátion amônio possui grande afinidade pelo ânion OH-(aq). Na solução, há grande quantidade de cátions amônio liberados pelo sal cloreto de amônio no 2º equilíbrio. Assim, ocorre a seguinte reação:
NH4+(aq) +OH-(aq) ⥄ NH4OH(aq)
Significa que o aumento de íons OH- devido à adição da base forte provoca um aumento proporcional de NH4OH(aq), e a variação de pH será muito pequena. O efeito tampão da solução irá cessar no momento em que todo os cátions amônio liberados pelo sal tiverem sido consumidos.
A adição de um ácido forte à solução-tampão, por exemplo o ácido iodídrico (HI), irá provocar a ionização do ácido:
HI(g) + H2O(l) ⥂ H3O+(aq) + I-(aq)
Os íons H3O+ do ácido são neutralizados pelos íons OH- do 1º equilíbrio:
H3O+(aq) + OH-(aq) ⥂ 2 H2O(l)
O 1º equilíbrio se desloca no sentido de aumentar a dissociação da base fraca. A variação de pH será muito pequena, pois a concentração de íons OH- em solução permanece praticamente constante. O efeito tampão da solução irá cessar no momento em que toda a base fraca tiver se dissociado.
Exemplos de solução-tampão
O conceito de solução-tampão é aplicado em diversos sistemas, como os sistemas enzimáticos relacionados com a proteína histidina, em processos da biotecnologia, quebra de DNA, eletroforese, entre outros.
O sangue também é um exemplo de solução-tampão, já que seu pH se mantém praticamente constante e igual a 7,4 mesmo quando ingerimos pequenas quantidades de ácidos fortes ou bases fortes.
O sangue apresenta uma solução-tampão chamada bicarbonato. Há a presença de duas substâncias: ácido carbônico (H2CO3) e bicarbonato de sódio (NaHCO3):
H2CO3 + H2O ↔ HCO3– + H+
NaHCO3 ↔ Na+ + HCO3–
Essa solução tampão é básica, já que o valor de seu pH varia de 7,35 a 7,45, e essa solução é formada por um ácido fraco (H2CO3) e o sal (NaHCO3 ).
No nosso corpo pode acontecer uma situação de aumento de acidez. Isso ocorre quando os pulmões não conseguem eliminar o CO2 produzido na respiração celular ou quando ocorre uma maior produção de ácidos por processos metabólicos.
Já uma situação de basicidade acontece com a presença de um excesso de base, provocado por uma hiperventilação pulmonar, eliminando um maior volume de CO2. Pode ser provocada ainda pelo metabolismo em virtude de alterações em íons importantes, como cloreto e potássio.
Videoaula
Exercícios sobre solução-tampão
Para terminar, resolva os exercícios sobre solução-tampão e veja se você está dominando o conteúdo!
1) (UFSCAR-SP) O pH do sangue humano de um indivíduo saudável situa-se na faixa de 7,35 a 7,45. Para manter essa faixa de pH, o organismo utiliza vários tampões, sendo que o principal tampão do plasma sanguíneo consiste de ácido carbônico e íon bicarbonato. A concentração de íons bicarbonato é aproximadamente 20 vezes maior que a concentração de ácido carbônico, com a maior parte do ácido na forma de CO dissolvido. O equilíbrio químico desse tampão pode ser representado pela equação:
CO2(g) + H2O(l) ↔ H2CO3 ↔ H+(aq) + HCO3-(aq)
Analise as seguintes afirmações:
I- quando uma pequena quantidade de base entra em contato com uma solução tampão, os íons hidróxido reagem com o ácido do tampão, não alterando praticamente o pH dessa solução.
II- quando a concentração de íons bicarbonato no sangue aumenta, o pH também aumenta.
III- quando a concentração de CO2 no sangue aumenta, o pH diminui.
São corretas as afirmações:
a) I, apenas
b) II, apenas
c) III, apenas
d) I e II, apenas
e) I, II e III
2) (FUVEST-SP) Dado o equilíbrio:
H3C-COOH(aq) ↔ H3C-COO-(aq) + H+(aq)
Com relação à adição de acetato de sódio, qual a afirmativa será correta?
a) o equilíbrio é perturbado, tendendo à esquerda e diminuindo a concentração de H+.
b) o equilíbrio é perturbado, porém a concentração de H+permanece invariável.
c) o equilíbrio é deslocado para a direita.
d) o equilíbrio não é perturbado.
e) o equilíbrio é deslocado para esquerda, e aumenta a concentração de H+.
3) (UEL-PR) As soluções tampão desempenham um papel importante em muitos processos químicos e biológicos. Por exemplo, o plasma sanguíneo é uma solução tampão eficiente em um meio no qual uma variação maior que 0,2 unidade de pH pode ocasionar a morte. Considere as afirmativas a seguir:
I- a dissolução do ácido em água para a preparação de uma solução tampão apresenta a constante de ionização igual a 1.
II- um exemplo de solução tampão é aquela que contém uma base fraca e um sal derivado dessa base fraca.
III- adicionando-se quantidades molares semelhantes de ácido acético e de acetato de sódio à água, obtém-se uma solução tampão.
IV- a solução tampão resiste às variações de pH, quando se adicionam pequenas quantidades de um ácido ou de uma base.
Assinale a alternativa correta:
a) somente as alternativas I e II são corretas
b) somente as alternativas I e IV são corretas
c) somente as alternativas III e IV são corretas
d) somente as alternativas I, II e III são corretas
e) somente as alternativas II, III e IV são corretas
GABARITO:
1) E
2) A
3) E





