As camadas dos elétrons: níveis e subníveis de energia
Você lembra como fazer a distribuição dos elétrons dos átomos nos seus níveis e subníveis? Que tal relembrar esse assunto e mandar bem na prova do Enem e dos vestibulares de todo Brasil? Não deixe de conferir o super-resumo que preparamos para você! Estude com a gente.
Há uma disposição natural que faz com que todas as coisas, todos os eventos, tendam sempre à uma situação de menor energia. Essa mesma tendência é observada na eletrosfera dos átomos. Os elétrons de um átomo sempre procuram se distribuir nos subníveis de menor energia, desde que haja lugar disponível.
A situação na qual os elétrons de um átomo se encontram nos subníveis de menor energia é chama de Estado Fundamental. Vamos ver como isso funciona? Revise os níveis e subníveis de energia de um átomo com esta aula de Química para o Enem!
Como foram descobertos os subníveis de energia?
Nas décadas de 1920 e 1930, a análise de espectros atômicos se mostrava uma das melhores maneiras de investigar a eletrosfera dos diferentes átomos. Muitos cientistas então concentraram seus esforços nesses estudos.
Introdução aos Níveis de Energia
Confira agora com o professor Felipe Sobis, do canal do Curso Enem Gratuito, os fundamentos para você dominar os Níveis de Energia:
Com a construção de aparelhos mais avançados para obter os espectros, perceberam que algumas de suas linhas apresentam uma estrutura fina, ou seja, puderam perceber que eram compostas por duas ou mais linhas muito próximas.
A estrutura fina dos espectros foi explicada quando os cientistas descobriram que os níveis de energia são formados por subdivisões, chamados de subníveis. Os subníveis são designados pelas letras minúsculas s,p,d,f,g,h etc.
As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K,L,M,N,O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.

Ao longo do tempo, estudos específicos para determinar a energia dos subníveis acabaram mostrando que:
- existe uma ordem crescente de energia nos subníveis;
s<p<d<f
• os elétrons de um mesmo subnível contêm a mesma quantidade de energia;
• os elétrons se distribuem pela eletrosfera ocupando o subnível de menor energia disponível.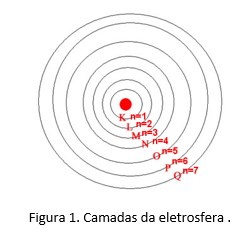
Investigando a ordem crescente de energia dos subníveis, os cientistas perceberam que o fenômeno interessante acontece: o subnível 4s, apesar de estar mais distante do núcleo que o subnível 3d, apresenta energia menor que a do subnível 3d. Muitos outros fenômenos desse tipo ocorrem entre os vários subníveis.
O Diagrama de Linus Pauling
Confira agora com a professora Larissa Campos, do canal do Curso Enem Gratuito, uma introdução bem simples para você dominar o Diagrama de Linus Pauling.
A criação de uma representação gráfica para os subníveis facilitou a visualização da sua ordem crescente de energia. Essa representação é conhecida como diagrama de Linus Pauling.
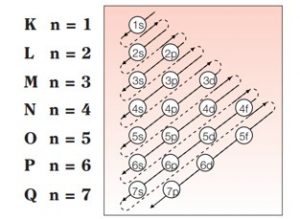
Seguindo o diagrama acima, na ordem das setas, o preenchimento da eletrosfera pelos elétrons em subníveis obedece à ordem crescente de energia definida pelo diagrama de Pauling:
1s˂ 2s˂ 2p˂ 3s˂ 3p ˂ 4s ˂ 3d ˂ 4p ˂ 5s ˂ 4d ˂ 5p ˂ 6s˂ 4f˂ 5d ˂ 6p ˂ 7s˂ 5f ˂ 6d
Os subníveis de energia comportam um número máximo de elétrons, veja:
| Subnível | Número máximo de elétrons |
| s | 2 |
| p | 6 |
| d | 10 |
| f | 14 |
Assim:
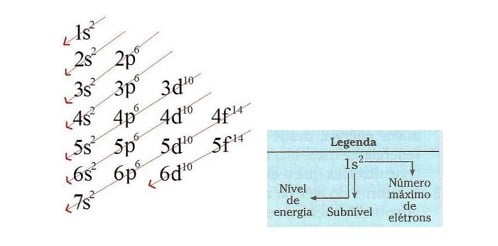
A “distribuição de elétrons” no átomo deve ser feita necessariamente em ordem de energia, que é indicada pelas setas no diagrama. A distribuição eletrônica em ordem energética termina com os elétrons mais energéticos do átomo no estado fundamental, aqueles que possuem a maior energia potencial e cinética (que não são necessariamente os mais externos do átomo).
O nível de energia mais externo de um átomo no estado fundamental é denominado camada de valência. A camada de valência é ocupada pelos elétrons de valência.
Vamos ver um exemplo de distribuição nos subníveis de energia?
Distribuição eletrônica do átomo de ferro (Z=26) no diagrama de
energia: Fe: Z = 26.
Como o número atômico do ferro é 26, temos 26 elétrons, pois está no seu estado neutro.
Escrevendo a distribuição eletrônica em ordem crescente de energia, temos:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Os elétrons mais energéticos do átomo de ferro no estado fundamental são os que possuem o estado de energia: 3d6.
A camada de valência (a última camada), contém os elétrons mais externos, que são os elétrons de valência: 4s2. Logo, o átomo de ferro possui 2 elétrons de valência no nível 4, no estado fundamental.
Exercícios sobre níveis e subníveis de energia
1) O ferro, sob forma de íons Fe2+(aq), é essencial para a formação de hemácias do sangue, responsáveis pelo transporte de oxigênio para todo o corpo. Na criança, a presença de hemoglobina tem papel importante na coordenação motora e da linguagem e no aumento da resistência a infecções; já na fase adulta, está associada à disposição e à capacidade produtiva. A deficiência de ferro no organismo pode ser identificada na contagem de glóbulos vermelhos, por meio de exames específicos de contagem de hemácias e pode causar, no período da gravidez, mortalidade do feto.
Associando-se essas considerações sobre a presença de íons de ferro no corpo humano aos conhecimentos da Química, é correto afirmar:
a) Os elétrons de maior energia dos íons Fe2+ são representados pela configuração eletrônica 4s2.
b) O transporte de oxigênio no sangue está relacionado à presença de ferro na oxi-hemoglobina.
c) A configuração eletrônica do íon Fe2+(aq) na hemoglobina é representada em ordem crescente de energia de níveis e subníveis pela representação [Ar]3d64s2.
d) Os íons do rutênio e do ósmio nos estados de oxidação +III substituem os íons de Fe2+ na hemoglobina porque pertencem ao mesmo grupo do elemento químico ferro.
e) A disposição física e a capacidade na fase adulta requerem o transporte de dióxido de carbono gasoso das células do sistema nervoso para os pulmões através do grupo heme.
2) O modelo atômico de Bohr, apesar de ter sido considerado obsoleto em poucos anos, trouxe como principal contribuição o reconhecimento de que os elétrons ocupam diferentes níveis de energia nos átomos. O reconhecimento da existência de diferentes níveis na eletrosfera permitiu explicar, entre outros fenômenos, a periodicidade química. Modernamente, reconhece-se que cada nível, por sua vez, pode ser subdividido em diferentes subníveis.
Levando em consideração o exposto, assinale a alternativa correta.
a) O que caracteriza os elementos de números atômicos 25 a 28 é o preenchimento sucessivo de elétrons no mesmo nível e no mesmo subnível.
b) Os três níveis de mais baixa energia podem acomodar no máximo, respectivamente, 2, 8 e 8 elétrons.
c) O terceiro nível de energia é composto por quatro subníveis, denominados s, p, d e f.
d) O que caracteriza os elementos de números atômicos 11 a 14 é o preenchimento sucessivo de elétrons no mesmo nível e no mesmo subnível.
e) Os elementos de números atômicos 10, 18, 36 e 54 têm o elétron mais energético no mesmo nível, mas em diferentes subníveis.
Respostas: 1b, 2a
Simulado de Distribuição Eletrônica
.






