Transformações cíclicas de um gás
Você sabia que que a palavra “cíclica” (nas transformações cíclicas) significa que o gás sai de um local e retorna a este mesmo local? Saiba mais sobre as transformações cíclicas e estude Química para o Enem e vestibulares.
Para começarmos os estudos das transformações cíclicas de um gás, precisamos antes ver as transformações gasosas. Um gás pode passar por três tipos de transformações diferentes: a isocórica, isotérmica e isobárica. Os três tipos de transformação envolvem as grandezas já estudadas: temperatura (T), volume (V) e pressão (P).
Transformações gasosas
Um gás pode sofrer 3 tipos de transformações: isotérmica, isovolumétrica e isocórica. Vejamos os 3.
Transformação isotérmica
A temperatura é mantida constante. Certa massa de um gás ocupa um volume inversamente proporcional à sua pressão. Ou seja, se aumentarmos 2 vezes a pressão de um gás, seu volume diminuirá 2 vezes. Quando duas grandezas variam em uma mesma proporção inversa, o produto entre elas é uma constante.
Pressão x Volume = constante
A relação PxV = constante foi determinada por Robert Boyle em 1662. Se uma dessas grandezas aumenta, a outra deve diminuir na mesma proporção, para que o produto permaneça constante. Assim, temos a fórmula:
Pressão inicial x Volume inicial = Pressão final x Volume final
Transformação isobárica
A pressão é mantida constante. O volume ocupado por certa massa de um gás é diretamente proporcional à sua temperatura absoluta. Ou seja, quando triplicamos a temperatura de um gás, o volume também será triplicado. Quando duas grandezas variam em uma mesma proporção direta, o quociente entre elas é uma constante.

A relação volume dividido por temperatura foi determinada por Gay-Lussac e por Charles. Se uma das grandezas aumenta, a outra deve aumentar na mesma proporção. Assim, temos a seguinte fórmula:

Quando a temperatura do gás aumenta, a energia cinética das moléculas do gás aumenta, consequentemente aumentando a velocidade com que elas estão se movendo. Assim, o gás aumenta de volume (em outras palavras, se expande).
Transformação isocórica / isovolumétrica / isométrica
O volume é mantido constante. A pressão exercida por certa massa de um gás é diretamente proporcional à sua temperatura absoluta. Temos: Pressão dividido por Temperatura = constante. Essa relação foi determinada por Charles e Gay-Lussac; assim, temos a seguinte fórmula:

Saiba mais sobre a relação entre temperatura, volume e pressão com a videoaula do prof. Sobis:
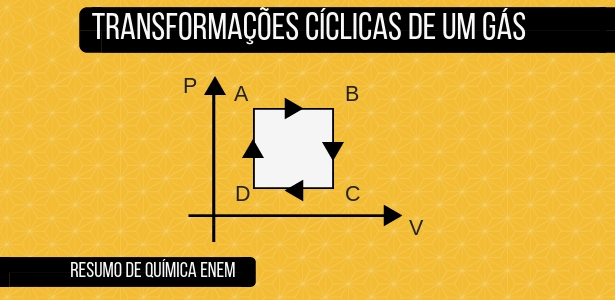
Transformações cíclicas de um gás
A primeira informação que devemos ter para estudar as transformações cíclicas de um gás em relação às variáveis de estado é que qualquer alteração em pelo menos uma das variáveis de estado (pressão, temperatura ou volume) representa mudança ou transformação de estado de um gás.
Para ser uma transformação cíclica é necessário que o estado final do gás seja o mesmo que o estado inicial (antes da transformação), ou seja, os valores de pressão, temperatura e volume sejam os mesmos dos valores iniciais.
As transformações cíclicas são diagramas para demonstrar os processos que os gases passam em um sistema. Elas representam um conjunto de transformações que se alternam e se repetem com o passar do tempo.
Você sabe também que a troca e a transformação de energia são fenômenos que ocorrem na natureza. A energia não é criada e nem destruída, mas sim, transformada. Nesse processo podemos relacionar Calor (Q) e Trabalho.
Calor e trabalho
O trabalho pode ser representado através de um gráfico, que considera a pressão e o volume. O trabalho será igual a área entre a curva do gráfico e o eixo do volume.
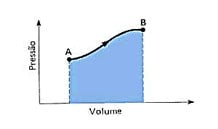
Para que ocorra trabalho é necessário mudança no volume. Neste, a energia interna (U) e a temperatura estão diretamente relacionadas: para ocorrer variação de energia interna é preciso que ocorra variação de temperatura.
ΔT = 0 ΔU = 0
ΔT > 0 ΔU > 0
ΔT < 0 ΔU < 0
ΔU = U final – U inicial
Quando a variação de energia interna for positiva, a temperatura aumenta; e quando a variação de energia interna for negativa, a temperatura diminui.
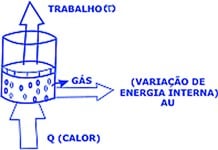
Quando fornecemos calor ao sistema, há um aumento maior da temperatura (com aumento da energia interna) e uma expansão do gás (ou seja, realização de trabalho).
Com isso, o calor fornecido ao sistema foi transformado na variação de energia interna e na realização de trabalho:
Q = Trabalho + ΔU
Resuminho: A variação da energia interna é igual a quantidade de calor menos o trabalho realizado:
ΔU = Q – Trabalho, onde:
Q = + quando recebe calor
Q = – quando perde calor
Trabalho = + quando o gás expande
Trabalho = – quando o gás se contrai
Importante: a variação de energia interna de uma transformação cíclica é nula. Durante a transformação, a temperatura do gás varia e consequentemente a sua energia interna também. Porém, como já falamos acima, o estado final do gás será o mesmo que o estado inicial, mesma coisa que ocorre com a energia interna. Ou seja, a energia interna inicial também será igual a energia interna final (ΔU = 0)
Agora que entendemos a variação de trabalho e energia interna, podemos ver o gráfico das transformações cíclicas, como o abaixo:
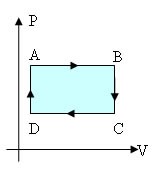
A transformação cíclica começa num ponto A, percorre o diagrama de Pressão x Volume, e volta novamente para o ponto A.
O cálculo da área dentro da curva dá o valor do trabalho realizado no ciclo. Os ciclos podem ser:
- no intervalo A – B há um aumento de volume, onde o calor é transformado em trabalho. Essa etapa do ciclo ocorre no sentido horário, gerando um trabalho positivo. Trabalho > 0
- no intervalo C – D há diminuição do volume, e o trabalho faz com que ocorra troca de calor. Essa etapa do ciclo ocorre no sentido anti-horário, gerando um trabalho negativo. Trabalho < 0
Videoaula
Vamos compreender melhor as transformações cíclicas de um gás? Então assista ao vídeo:
Exercício resolvido
1) Numa transformação isotérmica de um gás ideal, o produto P x V é constante, e vale 33.240J. A constante dos gases perfeitos é 8,31 J/mol.K, e o número de mols é igual a 5. Durante o processo, o gás recebe do meio exterior 2.000J de calor. determine:
a) o gás está sofrendo expansão ou compressão?
b) temperatura do processo
c) variação de energia interna do gás
d) trabalho realizado na transformação
Resolução:
a) o gás está recebendo calor, ou seja, ele expande.
b) P x V= 33.240J
P.V= n.R.T
n = 5
R = 8,31 J/mol.k
Aplicando a fórmula temos: 33.240 = 5. 8,31 . T
T = 800K
c) É uma transformação isotérmica, não há variação de temperatura, então a variação de energia interna é nula. ΔT = 0 e ΔU = 0
d) Q = 2000J
Aplicando a fórmula que vimos: ΔU = Q – Trabalho
0 = Q – Trabalho
Trabalho = Q
Trabalho = 2000J
Exercícios com gabarito
1) (UFMS -MS)
Sem variar sua massa, um gás ideal sofre uma transformação a volume constante. È correto afirmar que:
a) a transformação é isotérmica
b) a transformação é isobárica
c) o gás não realiza trabalho
d) sua pressão diminuirá, se a temperatura do gás aumentar
2) (FEI)
Numa transformação de um gás perfeito, os estados final e inicial acusaram a mesma energia interna. Certamente:
a) a transformação foi cíclica.
b) a transformação isométrica.
c) não houve troca de calor entre o gás e o ambiente.
d) são iguais as temperaturas dos estados inicial e final.
e) não houve troca de trabalho entre o gás e o meio.
3) (UFBA)
Em uma transformação isotérmica, mantida a 127°C, o volume de certa quantidade de gás, inicialmente sob pressão de 2,0 atm, passa de 10 para 20 litros. Considere a constante dos gases R, igual a 0,082 atm.R/mol.K
Tendo em vista a transformação acima, assinale o que for correto:
01) Na transformação, a densidade do gás é diretamente proporcional à pressão.
02) A energia interna permaneceu constante.
04) O sistema trocou calor com o meio ambiente.
08) Como a temperatura permaneceu constante, o sistema não trocou calor com o meio ambiente.
16) A energia interna aumentou.
32) A quantidade de calor recebida é igual ao trabalho realizado pelo gás na expansão.
64) A quantidade de calor trocado e o trabalho realizado são ambos nulos.
Gabarito:
- C
- D
- 32