Ácidos e bases: veja as definições, classificação e propriedades
Ácidos e Bases reagem entre si por Neutralização – e isso cai direto nas provas. Acontece quando íons H+ reagem com íons OH-, formando água. Veja isto e muito mais no resumo completo de Química sobre Ácidos e Bases.
As substâncias químicas em geral podem ser classificadas em orgânicas e inorgânicas. As orgânicas apresentam átomos de carbono os quais, geralmente formam estruturas de átomos de carbono ligados entre si. Para mandar bem no Enem é preciso dominar também Ácidos e Bases.
As substâncias inorgânicas, direta ou indiretamente são de origem mineral. Algumas delas contam também com átomos de carbono, como o dióxido de carbono, ![]() e o carbonato de cálcio
e o carbonato de cálcio ![]()
Além dessa classificação, também podemos classificar as substâncias químicas de acordo com suas funções. Neste post você vai revisar duas das funções químicas que mais aparecem no Enem e nos vestibulares: Os ácidos e as bases. Vem com a gente revisar Química para gabaritar Ciências da Natureza no Enem!
Ácidos
Cada função química reúne substâncias que apresentam propriedades semelhantes. Certas propriedades dos ácidos são usadas para identificá-los, como as relacionadas a seguir:
- Ácidos são eletrólitos: pois sofrem ionização em água, gerando uma solução condutora de corrente elétrica;
- Reagem com carbonatos
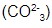 e bicarbonatos
e bicarbonatos 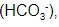 produzindo gás carbônico,
produzindo gás carbônico, 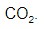
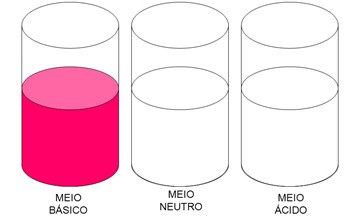
- Os ácidos atuam sobre a cor de indicadores ácido-base: Substâncias que assumem cores diferentes dependendo da acidez ou da basicidade da solução.
- Uma solução alcoólica de fenolftaleína, por exemplo, é incolor em meio ácido e em meio neutro, ou em meio levemente básico, e adquire coloração rósea em meio fortemente básico.
Resumo sobre ácidos
Bases
Agora que você já conhece as principais definições sobre os ácidos, vamos pensar nas características das bases:
- As bases, assim como os ácidos, também apresentam algumas propriedades em comuns (propriedades funcionais).
- As bases formam soluções eletrolíticas quando dissolvidas em água. Bases fortes são eletrólitos fortes (elevado grau de dissociação). As bases fracas, por terem baixa solubilidade em água e/ou baixo grau de ionização, apresentam também baixa condutividade elétrica.
- As bases reagem com ácidos por meio da reação de neutralização. Ácidos são neutralizados por base e vice-versa, pois os íons
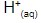 presentes na solução ácida reagem com íons
presentes na solução ácida reagem com íons 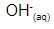 da solução básica, formando água.
da solução básica, formando água. - Atuam sobre a cor dos indicadores ácido-base. O extrato do repolho roxo, por exemplo, quando em contato com uma solução alcalina, sofre alteração da sua cor – passa do roxo para o azul ou verde, dependendo da concentração de íons hidroxila, OH-, presentes na solução.

Resumo sobre as bases
Veja com o professor Sobis uma aula-show sobre o que são as Bases:
Essas características que você acabou de revisar são definições “genéricas” sobre essas duas funções químicas.
Definições de ácidos e bases
Mas, o Enem pode te cobrar algumas definições mais específicas que levam o nome de seus atores. Vamos, então, relembrar as definições de Ácidos e bases segundo Arrhenius, Bronsted-Lowry e Lewis?
Definição de Arrhenius:
Ácidos são substâncias que em solução aquosa liberam íons positivos de hidrogênio (H+).
Bases são substâncias que em solução aquosa, liberam hidroxilas, íons negativos OH–.
Você pode complementar as definições de Arrhenius neste resumo completo sobre Funções Inorgânicas.
Definição de Bronsted-Lowry:
Ácido é uma substância capaz de ceder um próton a uma reação.
Base é uma substância capaz de receber um próton.
Definição de Lewis:
Ácidos são substâncias que em numa ligação química, podem receber pares eletrônicos.
Bases são substâncias que cedem pares eletrônicos.
É possível medir a concentração de hidrogênio iônico em uma solução a partir de uma escala logarítmica inversa, que recebeu o nome de potencial hidrogeniônico, ou simplesmente, escala de pH.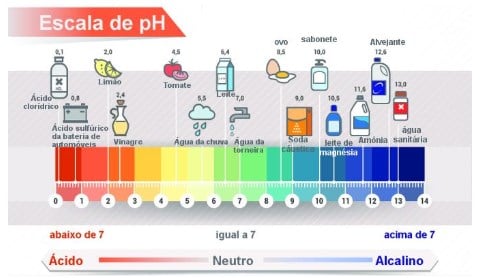 Escala de pH
Escala de pH
Principais ácidos e bases e suas aplicações
– Ácido Sulfúrico ![]() É o nome comercial da solução aquosa de sulfato de hidrogênio. Esse ácido é utilizado em vários processos industriais, por exemplo, na fabricação do papel e de corantes, na produção de inseticidas, de fertilizantes, de explosivos e de outros ácidos. As baterias de automóveis contém solução aquosa de ácido sulfúrico.
É o nome comercial da solução aquosa de sulfato de hidrogênio. Esse ácido é utilizado em vários processos industriais, por exemplo, na fabricação do papel e de corantes, na produção de inseticidas, de fertilizantes, de explosivos e de outros ácidos. As baterias de automóveis contém solução aquosa de ácido sulfúrico.
– Ácido nítrico, ![]() É utilizado na fabricação de corantes, pesticidas, fertilizantes, explosivos (TNT e nitroglicerina) e fibras sintéticas.
É utilizado na fabricação de corantes, pesticidas, fertilizantes, explosivos (TNT e nitroglicerina) e fibras sintéticas.
– Ácido Clorídrico: Em solução aquosa é muito utilizada na limpeza e galvanização de metais, no curtimento de couros e na obtenção de vários produtos.
– Hidróxido de sódio ![]() Comercializado como soda cáustica, é muito utilizada, como por exemplo em uma das etapas do processo de fabricação do papel, tecidos e produtos de uso doméstico.
Comercializado como soda cáustica, é muito utilizada, como por exemplo em uma das etapas do processo de fabricação do papel, tecidos e produtos de uso doméstico.
– Amônia, ![]() é utilizada na fabricação de ácido nítrico,
é utilizada na fabricação de ácido nítrico, ![]() na produção de fertilizantes, em amaciantes de roupas, em tintas e amaciantes de roupas e tintas e alisantes para cabelos e em desinfetantes.
na produção de fertilizantes, em amaciantes de roupas, em tintas e amaciantes de roupas e tintas e alisantes para cabelos e em desinfetantes.
Exercícios
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(PUC GO/2017)
No sábado à tarde, o mormaço: a praça dorme, sem vivalma. Quando começa a escurecer, ganha vida, fervilha, um corpo vivo, um lodaçal cheio de vermes, amebas e neurônios se misturando. Filhos de fazendeiros abonados estacionam suas caminhonetes novas, cada qual enumerando vantagens e se vangloriando.
Sim, havia comprado outra fazenda, não era reserva indígena? mas o que importa? O filho se sente peixe grande. Não trabalha. Muitos dos que estão na praça estudam nas capitais. Cuiabá, Brasília, Belém, Manaus… Estudam? Que nada! Festas, muitas festas. Bebedeira e drogas. A música rebenta os tímpanos. Cada caminhonete está equipada com som potente. É vitorioso quem deixa a praça trepidante. Bom gosto? Para eles. A praça vibra, treme, as árvores se encolhem. Os novos cowboys — chapéu, cinturão e botas — sentem-se donos do mundo.
[…]
As garotas ricas e pobres desfilam na grande calçada, com shorts e vestidos curtos, maquiladas, cópias das revistas de moda. Todas querem o seu quinhão: os filhos mimados dos fazendeiros. O golpe do baú. Aqueles moços mimados valem por alqueire de soja e pastagem de nelore. Quem sabe, uma delas recebe o prêmio da loteria, o bilhete premiado. Esbanjam sensualidade, balançam os quadris, suspendem os seios, provocam o demônio. O fulano de tal… Aquele mesmo! Olha que gato, um galã de novela. Meu Deus, aquele da caminhonete! Você viu as botas que está usando? Uma fortuna. Ah, quem dera que me olhasse… […]
(GONÇALVES, David. Sangue verde.
Joinville: Sucesso Pocket, 2014. p. 163. Adaptado.)O texto faz alusão a festas. Nas festas em que os jovens se soltam, ou melhor, se acabam, é muito comum a presença de drogas, sejam elas licitas (bebida alcóolica) ou ilícitas (cocaína, LSD, ecstasy etc.). O uso dessas drogas provoca as mais variadas reações no corpo humano, deixando a pessoa desde desinibida, para chegar em alguém e conversar, até mesmo a ficar totalmente fora de si, passando horas agitada, elétrica. O LSD provoca alucinações; a cocaína, euforia e o ecstasy, conhecido como MDMA, uma mistura moderada dos efeitos de ambas as substâncias. Na molécula de ecstasy há a presença da função orgânica amina, mais precisamente uma amina secundaria. Sobre essa função orgânica, assinale a resposta correta:
CorretoParabéns, resposta correta! Continue com o Simulado.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre ácidos e bases para acertar na hora da prova!
-
Pergunta 2 de 10
2. Pergunta
(UDESC SC/2017)
Numere a coluna relacionando a descrição da função química à espécie que ela representa.
1. NH4+
2. CO2
3. NH3
4. KMnO4( ) É um óxido, nesta classe de compostos o elemento oxigênio é o elemento mais eletronegativo.
( ) É uma base e, segundo Brønstead-Lowry, pode receber um ou mais prótons.
( ) É um ácido, segundo Brønstead-Lowry, cuja definição de ácido é qualquer espécie química que exiba tendência a doar prótons (íons H+).
( ) É um sal, e essa classe de compostos é um dos produtos da reação entre um ácido e uma base.Assinale a alternativa que contém a sequência correta, de cima para baixo.
CorretoParabéns, resposta correta! Continue com o Simulado.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre ácidos e bases para acertar na hora da prova!
-
Pergunta 3 de 10
3. Pergunta
(UFJF MG/2015)
De acordo com as teorias de Arrhenius, Brönsted-Lowry e Lewis, diferentes substâncias podem ser reconhecidas como ácidos ou bases. Assinale a alternativa que apresenta substâncias classificadas como ácidos de acordo com as teorias de Arrhenius, Brönsted-Lowry e Lewis, respectivamente.
CorretoParabéns, resposta correta! Continue com o Simulado.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre ácidos e bases para acertar na hora da prova!
-
Pergunta 4 de 10
4. Pergunta
(FCM PB/2015)
Diante do tão grande número de substâncias, surgiu a necessidade de agrupá-las em funções. Ácidos, bases, sais e óxidos constituem funções químicas inorgânicas. Cada uma destas funções apresenta propriedades e características semelhantes. São várias as teorias propostas para explicar o comportamento de ácidos e bases. Arrhenius, Brönsted-Lowry, Lewis foram alguns dos cientistas que propuseram teorias para explicar o comportamento ácido ou básico de diferentes espécies e em meios diferentes. Baseado nas teorias propostas para definir as funções inorgânicas analise as afirmativas abaixo.
I. Segundo o conceito de Brönsted-Lowry, ácido é toda substância capaz de ceder prótons e base aquela que aceita prótons. Desta forma, ácidos podem ser moléculas, ânions e cátions e bases moléculas e ânions.
II. Quando NH3 reage com BF3 para formar o NH3BF3, o NH3 se comporta como base de Lewis e BF3 como ácido de Lewis.
III. O HCl é um ácido de Arrhenius, pois quando sofre dissociação em água libera íon H+.
IV. Os óxidos são compostos binários e podem apresentar caráter ácido como o P2O5, básicos como o Na2O, neutros como o NO ou anfóteros como o Al2O3.Estão corretas as afirmativas:
CorretoParabéns, resposta correta! Continue com o Simulado.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre ácidos e bases para acertar na hora da prova!
-
Pergunta 5 de 10
5. Pergunta
(ENEM/2014)
Grande quantidade dos maus odores do nosso dia a dia está relacionada a compostos alcalinos. Assim, em vários desses casos, pode-se utilizar o vinagre, que contém entre 3,5% e 5% de ácido acético, para diminuir ou eliminar o mau cheiro. Por exemplo, lavar as mãos com vinagre e depois enxaguá-las com água elimina o odor de peixe, já que a molécula de piridina (C5H5N) é uma das substâncias responsáveis pelo odor característico de peixe podre.
SILVA, V. A.; BENITE, A. M. C.; SOARES, M. H. F. B. Algo aqui não cheira bem…
A química do mau cheiro. Química Nova na Escola, v. 33, n. 1, fev. 2011 (adaptado).A eficiência do uso do vinagre nesse caso se explica pela
CorretoParabéns, resposta correta! Continue com o Simulado.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre ácidos e bases para acertar na hora da prova!
-
Pergunta 6 de 10
6. Pergunta
(PUC RJ/2013)
Considere o equilíbrio químico abaixo:
H2PO4–(aq) + NH3(aq)
 HPO42–(aq) + NH4+(aq)
HPO42–(aq) + NH4+(aq)De acordo com o conceito de Brönsted-Lowry que define, num equilíbrio, o ácido e a base levando em conta a espécie que doa e a espécie que recebe prótons (H+), é correto afirmar que:
CorretoParabéns, resposta correta! Continue com o Simulado.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre ácidos e bases para acertar na hora da prova!
-
Pergunta 7 de 10
7. Pergunta
(UNCISAL/2012)
Ácidos e bases são os grandes pilares de toda a vida de nosso planeta, bem como da maioria das propriedades do reino mineral, sendo costumeiramente lembrados como substâncias químicas perigosas, corrosivos capazes de dissolver metais como se fossem comprimidos efervescentes; no entanto, a presença destas substâncias na nossa vida cotidiana é bem mais ampla e menos agressiva do que se imagina. O conceito de ácido e de base foi evoluindo ao longo do tempo, de acordo com os conhecimentos da época e também com a necessidade crescente de explicar fenômenos associados à acidez e à basicidade. Com respeito às propriedades de ácidos e bases, indique a opção correta.
CorretoParabéns, resposta correta! Continue com o Simulado.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre ácidos e bases para acertar na hora da prova!
-
Pergunta 8 de 10
8. Pergunta
(UFT TO/2011)
Com base na definição de ácido-base de Brönsted-Lowry, analise os grupos funcionais que representam os compostos orgânicos listados a seguir: ésteres, haletos orgânicos, cetonas, fenóis, álcoois e aminas.
Assinale a alternativa CORRETA:
CorretoParabéns, resposta correta! Continue com o Simulado.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre ácidos e bases para acertar na hora da prova!
-
Pergunta 9 de 10
9. Pergunta
(UFCG PB/2009)
Considerando as possíveis reações que podem ocorrer entre as espécies: H3O+, H2O, OH– e H+, identifique o número de espécies que agem como ácido e como base de Lewis e assinale a alternativa CORRETA.
CorretoParabéns, resposta correta! Continue com o Simulado.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre ácidos e bases para acertar na hora da prova!
-
Pergunta 10 de 10
10. Pergunta
(FPS PE/2015)
Compostos de boro estão sendo utilizados com mais frequência em sínteses orgânicas, especialmente de fármacos e produtos naturais. Um composto de boro importante é o trifluoreto de boro, BF3, que possui estrutura trigonal plana. O número atômico do boro é 5, e do flúor é 9. Sobre este composto podemos afirmar que:
CorretoParabéns, resposta correta! Continue com o Simulado.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre ácidos e bases para acertar na hora da prova!
Sobre o(a) autor(a):
Martha Ramos -
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


