Classificação dos átomos em isóbaros, isótopos e isótonos
A classificação dos átomos baseia-se na quantidade de elétrons, prótons e nêutrons, e tem relação com o Número Atômmico, e com o Número de Massa. Veja no resumo de Química como os átomos podem ser designados entre si por isótopos, isóbaros ou isótonos.
Como já sabemos, a estrutura básica do átomo conhecida atualmente considera o átomo dividido em duas regiões: núcleo e eletrosfera. Nesta aula, você irá conhecer a classificação dos átomos em relação à quantidade de elétrons, prótons e nêutrons.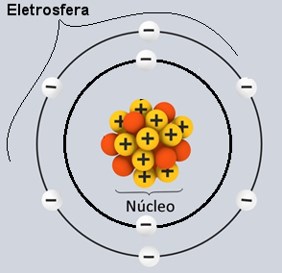 Estrutura básica do átomo.
Estrutura básica do átomo.
Não lembra o que são elétrons, prótons e nêutrons? Veja: nesse modelo básico, o núcleo, que é a região central do átomo, contém dois tipos de partículas, os prótons e os nêutrons; e a eletrosfera, que é a região periférica ao redor do núcleo, contém apenas os elétrons.
Vamos conhecer as principais características de cada partícula? Veja os dados na tabela a seguir: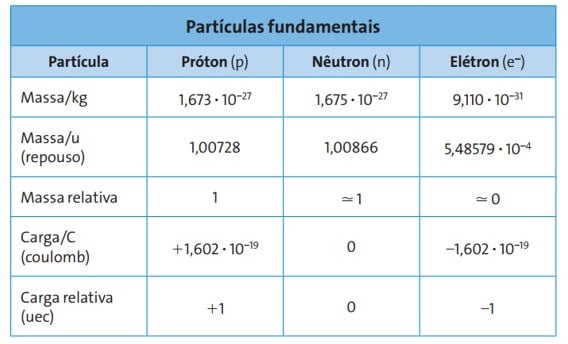 Após a descoberta dos elétrons, dos prótons e dos nêutrons, os cientistas perceberam que a quantidade dessas partículas dentro de um determinado átomo serviria para identificá-lo.
Após a descoberta dos elétrons, dos prótons e dos nêutrons, os cientistas perceberam que a quantidade dessas partículas dentro de um determinado átomo serviria para identificá-lo.
Resumo da Estrutura Atômica
Para ajudar você a compreender e fechar bem este primeiro bloco da aula, sobre a Estrutura Atômica, confira com o professor Sobis as dicas para você avançar logo em seguida para dominar a Classificação dos Átomos em Isótonos, Isóbaros, e Isótopos:
Número atômico e de massa
Para entender a classificação dos átomos em isóbaros, isótopos e isótonos, precisamos conhecer os conceitos de número atômico e de massa.
Número atômico (Z)
Número atômico (Z) é o número de prótons existentes no núcleo de um átomo.
Em um átomo neutro, cuja carga elétrica é zero, o número de prótons é igual ao número de elétrons. Por exemplo, quando o átomo de sódio (Na) tem número atômico 11, isso quer dizer que no núcleo desse átomo existem 11 prótons e, consequentemente 11 elétrons na sua eletrosfera.
Número de massa (A)
Número de massa (A) é a soma do número de prótons e de nêutrons (N) existentes em um átomo. Matematicamente, A = Z + N.
É o número de massa que informa se um átomo tem massa maior do que o outro, pois apenas os prótons e os nêutrons dão massa ao átomo, uma vez que a massa dos elétrons é desprezível.
Veja o exemplo:
O átomo de sódio tem 11 prótons, 12 nêutrons e 11 elétrons. Temos então, para esse elemento químico:
– número atômico: Z = 11 (no = de prótons = no de elétrons);
– número de nêutrons = N = 12
– número de massa: A = Z + N → A = 11 + 12 → A = 23
Classificação dos átomos em isóbaros, isótopos e isótonos
Essa classificação dos átomos também é chamada de semelhança eletrônica.
Átomos Isótopos
São átomos que apresentam o mesmo número atômico (Z), por pertencerem ao mesmo elemento químico, mas diferentes números de massa (A).
A maioria dos elementos químicos é constituída por uma mistura de isótopos, os quais podem ser encontrados, na natureza, em proporção praticamente constante. Veja, a seguir, os isótopos naturais de alguns elementos químicos e as proporções nas quais eles são encontrados: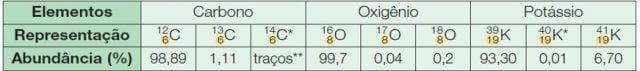
O hidrogênio é uma exceção
O único elemento químico cujos isótopos apresentam nome próprio é o hidrogênio (H), que é formado pelos seguintes isótopos naturais: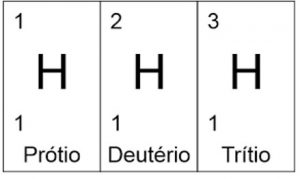
Átomos Isóbaros
São átomos que apresentam diferentes números atômicos (Z), mas mesmo número de massa (A).
Exemplo:
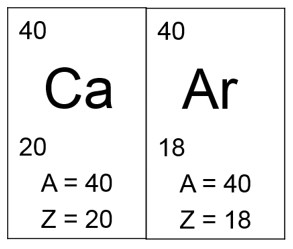
Os isóbaros pertencem, portanto, a elementos químicos diferentes.
Átomos Isótonos
São átomos que apresentam o mesmo número de nêutrons (n), mas diferentes números atômicos (Z) e de massa (A).
Exemplo: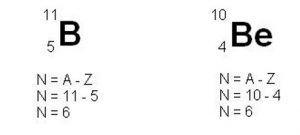
Isoeletrônicos
Átomos e íons que apresentam a mesma quantidade de elétrons.
Exemplo: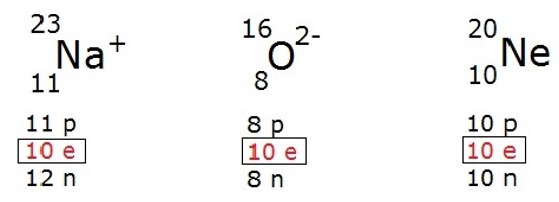
Videoaula sobre semelhanças atômicas
Para finalizar sua revisão sobre a classificação dos átomos, assista à videoaula do canal do Curso Enem Gratuito, com o prof. Felipe Sobis:
Exercícios sobre classificação dos átomos
(UFSC) Dados os átomos:

Indique as proposições verdadeiras.
a) I e III são isótopos.
b) II e IV possuem o mesmo número de massa.
c) I e IV têm igual número de nêutrons.
d) I e II possuem o mesmo número de massa.
e) II e III são isótopos.
(UA-AM) Em relação à isotopia, isobaria e isotonia, podemos afirmar que:
a) isótonos são entidades químicas que possuem o mesmo número de nêutrons.
b) isóbaros são entidades químicas que possuem o mesmo número de prótons.
c) isótopos são entidades químicas que possuem o mesmo número de massa.
d) são relações que dizem respeito ao núcleo e à eletrosfera do átomo.
e) são relações que dizem respeito apenas à eletrosfera do átomo.
Resposta: 1) verdadeiras A,C,D; 2) A.
Simulado de classificação dos átomos
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(UERJ/2018)
O desastre de Chernobyl ainda custa caro para a Ucrânia. A radiação na região pode demorar mais de 24000 anos para chegar a níveis seguros.
Adaptado de Revista Superinteressante, 12/08/2016.Após 30 anos do acidente em Chernobyl, o principal contaminante radioativo presente na região é o césio-137, que se decompõe formando o bário-137.
Esses átomos, ao serem comparados entre si, são denominados:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 2 de 10
2. Pergunta
(FATEC SP/2017)
Cinco amigos estavam estudando para a prova de Química e decidiram fazer um jogo com os elementos da Tabela Periódica:
cada participante selecionou um isótopo dos elementos da Tabela Periódica e anotou sua escolha em um cartão de papel;
os jogadores Fernanda, Gabriela, Júlia, Paulo e Pedro decidiram que o vencedor seria aquele que apresentasse o cartão contendo o isótopo com o maior número de nêutrons.Os cartões foram, então, mostrados pelos jogadores.

Observando os cartões, é correto afirmar que o(a) vencedor(a) foi
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 3 de 10
3. Pergunta
(UNITAU SP/2015)
O oxigênio gasoso também existe na atmosfera sob uma outra forma, denominada de ozônio. Assim, afirma-se que oxigênio e ozônio são
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 4 de 10
4. Pergunta
(Fac. Anhembi Morumbi SP/2014)
O oxigênio foi descoberto por Priestley em 1722. A partir de 1775, Lavoisier estabeleceu suas propriedades, mostrou que existia no ar e na água, e indicou seu papel fundamental nas combustões e na respiração. Na natureza, o elemento químico oxigênio ocorre como uma mistura de 16O, 17O e 18O. Na baixa atmosfera e à temperatura ambiente, o oxigênio está presente principalmente na forma de moléculas diatômicas (O2) que constituem um gás incolor, inodoro e insípido, essencial para os organismos vivos. São inúmeras as aplicações do oxigênio. Na medicina, o seu uso mais comum é na produção de ar enriquecido de O2.
(http://tabela.oxigenio.com. Adaptado.)Sobre a ocorrência natural do elemento químico oxigênio, é correto afirmar que 16O, 17O e 18O possuem, respectivamente,
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 5 de 10
5. Pergunta
(PUC RJ/2014)
O antimônio tem dois isótopos, o 121Sb e o 123Sb. Sobre esses isótopos, verifica-se que:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 6 de 10
6. Pergunta
(UNCISAL/2013)
Átomos de um mesmo elemento químico têm números atômicos iguais, e quando os números de massa desses átomos são diferentes eles são chamados de isótopos. Exemplos de isótopos são os átomos de Carbono 12 e Carbono 14, esse último muito utilizado para a datação de fósseis, podendo datar objetos de milhões de anos. Com base nos conhecimentos da estrutura do átomo, dadas as afirmações abaixo,
I. Dentre os isótopos do elemento Hidrogênio, o prótio
 é o mais estável.
é o mais estável.
II. O ozônio é o isótopo mais importante do elemento oxigênio, pois a camada de ozônio protege a terra das radiações ultravioleta do sol.
III. Átomos de diferentes elementos químicos e com mesmo número de massa mostram semelhanças em suas propriedades químicas.
IV. O átomo de carbono 14 tem 6 prótons e 8 nêutrons no núcleo.verifica-se que estão corretas
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 7 de 10
7. Pergunta
(UDESC SC/2012)
Assinale a alternativa correta. Os isótopos são átomos:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 8 de 10
8. Pergunta
(UESPI/2010)
Considere as espécies químicas monoatômicas apresentadas na tabela a seguir:

Com relação às espécies químicas monoatômicas apresentadas acima, pode-se afirmar que:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 9 de 10
9. Pergunta
(UFAC/2010)
) A energia gerada pelas usinas de energia nuclear é produzida pela fissão nuclear. O combustível nuclear deve ser uma substância de natureza físsil como o 235U. Na natureza, o urânio é encontrado na composição de 99,284% do isótopo 238U e 0,711% do isótopo 235U. Para ser usado como combustível nuclear, o urânio é submetido a um processo de enriquecimento, a fim de concentrar na mistura de isótopos o teor do isótopo físsil.
Com relação aos isótopos 235U e 238U, é incorreto afirmar que os mesmos possuem:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 10 de 10
10. Pergunta
(UEM PR/2006)
Assinale o que for correto.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!

Sobre o(a) autor(a):
Munique Dias - Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia Química, também pela UFSC.
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


