Diluição de soluções químicas
Em nosso cotidiano estamos habituados a acrescentar água nos sucos de frutas concentrados para diminuir sua concentração. Também acrescentamos água em produtos de limpeza, tornando-os menos concentrados. Entenda os princípios da diluição das soluções químicas nesta aula para o Enem!
Vem com a gente revisar a diluição das soluções químicas para mandar bem no Enem e nos vestibulares!
O que são soluções?
As soluções são misturas homogêneas formadas por soluto e solvente. Não esqueça que o solvente mais comum utilizado nas questões de vestibulares é a água. É importante que você tenha em mente também que a água é considerada o solvente universal, pois dissolve grande parte das substâncias que circulam em nosso organismo.
Diluição de uma solução
Diluir uma solução significa adicionar a ela uma porção de solvente puro. A diluição é feita adicionando-se água à solução. Como exemplo podemos citar a diluição da limonada: para diminuir a acidez da limonada, adicionamos água e ficamos com uma solução menos ácida ou mais diluída.

No exemplo acima, a solução concentrada (jarra do meio) possui grande quantidade de soluto em pouca quantidade de solvente. Ao receber uma quantidade extra de solvente (água), tem seu volume final aumentado.
Diluição química
Ao adicionar solvente a uma certa solução, estamos fazendo uma diluição. Nesse processo, a quantidade de solvente é aumentada e a quantidade de soluto permanece constante. Essa mudança provoca uma diminuição da concentração da solução.
Quando o solvente é retirado ou acrescentado a uma solução, a quantidade de soluto (em massa, quantidade de matéria, volume ou número de equivalentes) permanece inalterada.
O volume final da solução, quando há adição de solvente, é sempre maior que o volume inicial. E quando há retirada de solvente, o volume final da solução é sempre menor que o volume inicial.
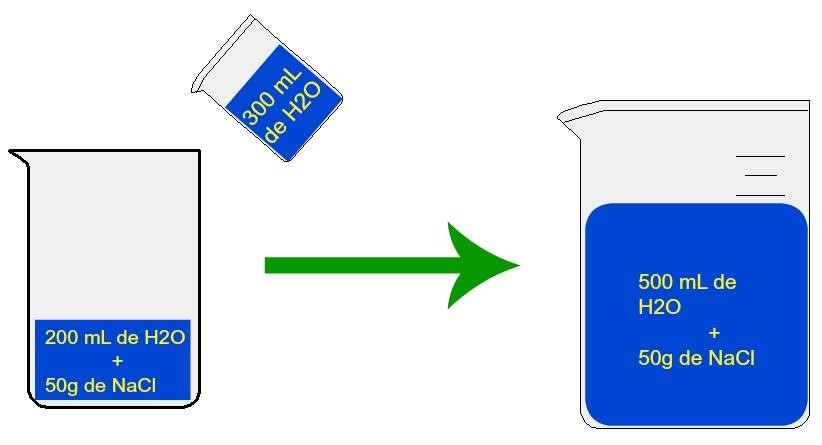
Neste experimento observamos que, antes da adição de 300 ml de água, tínhamos 200 ml de água e 50 g de Nacl. Após a adição de 300 ml de água, a solução passou a ter 500 ml de água e os mesmos 50 g de NaCl.
Fórmulas
Para compreender o processo de diluição, devemos conhecer a solução em seu momento inicial e após a adição do solvente.
Temos a solução inicial:
Ci – m1 / Vi
onde
- Ci = concentração inicial
- m1 = massa do soluto
- Vi = volume inicial
Temos a solução final:
Cf = m1 / Vf
onde
- Cf = concentração final
- m1 = massa do soluto
- Vf = volume final
Como a massa do soluto é a mesma antes e depois da variação na quantidade de solvente, então os produtos da concentração em massa pelo volume nas soluções inicial e final são iguais.
Temos então a seguinte fórmula: Ci . Vi = Cf . Vf
Na diluição, assim como na concentração de soluções, podemos trabalhar com a concentração em quantidade de matéria ou molaridade (M) expressa pela seguinte fórmula:
M = n1 / V
onde
M = molaridade
n1 = quantidade de matéria do soluto (mol)
V = volume da solução
Teremos também a solução inicial e a final:
n1 na solução inicial é igual a n1 na solução final:
n1 = Mi . Vi
n1 = Mf . Vf
Portanto, temos a fórmula: Mi . Vi = Mf . Vf
Vamos entender como aplicar essas fórmulas?
Exercícios resolvidos
Acompanhe abaixo a resolução de exercícios sobre a diluição de soluções químicas.
1) Ao diluir 100 ml de uma solução de concentração igual a 15g/L ao volume final de 150 ml, qual a nova concentração?
Resolução:
Vi = 100 ml
Ci = 15 g/L
Vf = 150 ml
Cf = ?
Ci . Vi = Cf . Vf
15 . 100 = Cf . 150
Cf = 1500/150
Cf = 10 g/L
2) Foram adicionados 200 ml de uma solução aquosa de glicose de concentração 60 g/L a 300 ml de uma solução de glicose de concentração 120 g/L. Calcular a concentração da solução final:
Resolução:
C1 = 60
V1 = 200
C2 = 120
V2 = 300
Cf = ?
Vf = 500
C1 . V1 + C2 . V2 = Cf . Vf
60 . 200 + 120 . 300 = Cf . 500
Cf = 96 g/L
Videoaula
Vamos agora assistir a um vídeo para melhorar nossos conhecimentos sobre diluição? Confira abaixo a videoaula gravada com o professor Sobis, do Curso Enem Gratuito!
Exercícios
1) (UEL) Misturam-se 200 ml de solução de hidróxido de potássio de concentração 5 g/L com 300 ml de solução da mesma base com concentração de 4 g/L. A concentração em g/L da solução final vale:
a) 0,5
b) 1,1
c) 2,2
d) 3,3
e) 4,4
Resolução:
C1 . V1 + C2 . V2 = Cf . Vf
200 . 5 + 300 . 4 = Cf . 500
Cf = 4,4 g/L
Gab: e
2) (Unesp -SP) Na preparação de 750 ml de solução aquosa de H2SO4 de concentração igual a 3,0 mol/L a partir de uma solução -estoque de concentração igual a 18,0 mol/L, é necessário utilizar um volume de solução-estoque, expresso, em ml, igual a:
a) 100
b) 125
c) 250
d) 375
e) 500
Gab: b
3) (Fuvest -SP) Se adicionarmos 80 ml de água a 20 ml de uma solução 0,20M de hidróxido de potássio, obteremos uma solução de concentração molar igual a :
a) 0,010
b) 0,020
c) 0,025
d) 0,040
e) 0,050
Gab: d
4) (FUC -MT) Na diluição de uma solução, podemos afirmar que:
a) a massa do solvente permanece constante
b) a massa do soluto permanece constante
c) o volume da solução permanece constante
d) a molaridade da solução permanece constante
Gab: b





