Soluções químicas e suas classificações
Você sabia que as substâncias, na natureza, dificilmente se encontram na sua forma pura? Normalmente, elas se apresentam na forma de misturas, e as misturas homogêneas são denominadas de soluções. Podemos citar como exemplo de solução o soro fisiológico e a água mineral. Então venha estudar conosco e se preparar para a prova do Enem!
Todos nós já fizemos soluções químicas pelo menos uma vez na vida. Agora é hora de parar pra pensar na teoria das soluções!
O que são soluções químicas
As soluções químicas são misturas homogêneas. Ou seja, são misturas formadas apenas por uma fase. Sendo assim, podemos dizer que as solução são misturas formadas por duas ou mais substâncias, onde não se consegue distinguir seus componentes, pois as substâncias se dissolvem.

Soluto e solvente
Como você pode observar na imagem 1, as soluções são formadas por soluto e solvente. O soluto, como o esquema mostra, é a substância que se encontra dispersa no solvente, sendo a substância que será dissolvida. Geralmente, apresenta-se em menor quantidade na solução. Por sua vez, o solvente é a substância na qual o soluto será dissolvido para formar um novo produto. Apresenta-se em maior quantidade na solução.
Solvente universal
A água é o solvente mais conhecido, sendo considerado o solvente universal. Isso porque a água tem a capacidade de dissolver uma grande quantidade de substâncias. Como exemplo de solução, podemos citar a mistura de água com açúcar, sendo a água o solvente e o açúcar o soluto.
Soluções sólidas, líquidas e gasosas
As soluções podem ser formadas por qualquer combinação, envolvendo os três estados físicos da matéria: líquido, sólido e gasoso. Assim, são classificadas como:
- Soluções sólidas: formadas por soluto e solvente no estado sólido. Exemplo: união de cobre e níquel, formando uma liga metálica.
- Soluções líquidas: formadas por solvente no estado líquido e solutos que podem estar no estado líquido, sólido ou gasoso. Exemplo: água do mar, sal dissolvido em água.
- Soluções gasosas: formadas por solutos e solventes no estado gasoso. Exemplo: ar atmosférico.
Coeficiente de solubilidade
O solvente e o soluto podem apresentar diferentes quantidades e características. Além disso, há uma quantidade limite ou quantidade máxima de soluto que se dissolve em certa quantidade de solvente, que representa o coeficiente de solubilidade.
O coeficiente de solubilidade (Cs) representa a quantidade máxima de soluto que pode ser dissolvida em certa quantidade de solvente, a uma certa temperatura. O coeficiente de solubilidade depende da natureza do soluto e do solvente e ajuda a determinar a saturação das soluções químicas.
As substâncias possuem valores de coeficiente de solubilidade diferentes, conforme a temperatura em que se encontram e a quantidade de solvente em que estão dissolvidas. Como exemplo, temos uma tabela de solubilidade de algumas substâncias em um litro de água a 20ºC:
| Substância | Solubilidade (g/L) |
| Sal (NaCl) | 360 |
| Açúcar (C12H22O11) | 330 |
| Cloreto de potássio (KCl) | 74 |
| Iodo sólido (I2) | 0,16 |
| Sulfato de cobre (CuSO4) | 207 |
| Cal apagada (Ca(OH)2) | 1,6 |
| Bicarbonato de sódio (NaHCO3) | 96 |
| Cloreto de chumbo (PbCl2) | 99 |
Tabela 1: Tabela contendo a quantidade de variadas substâncias que podem ser completamente dissolvidas por 1 litro de água.
Classificação das soluções químicas
Quanto à saturação: soluções insaturadas, saturadas e supersaturadas
De acordo com ponto de saturação, as soluções podem ser classificadas em insaturada, saturada e supersaturada.
Uma solução insaturada é aquela que contém menor quantidade de soluto do que a estabelecida pelo coeficiente de solubilidade.

Solução saturada é aquela que usa a quantidade máxima de soluto para ser totalmente dissolvido pelo solvente. Caso mais soluto seja acrescentado, pode-se acumular, sendo esse excesso chamado de precipitado ou corpo de fundo (parte do soluto que não se dissolve no solvente).

Enfim, soluções supersaturadas são soluções instáveis, onde a quantidade de soluto excede a capacidade de solubilidade do solvente. A mínima perturbação do sistema, faz com que o excesso de soluto dissolvido precipite, tornando-se uma solução saturada com presença de corpo de fundo.

Quanto à solubilidade: soluções diluídas e concentradas
A classificação das soluções químicas conforme sua solubilidade, isto é, sua capacidade de se dissolver, divide as soluções em diluídas e concentradas. Nas soluções diluídas, a quantidade de soluto é menor em relação ao solvente. Por sua vez, temos uma solução concentrada quando a quantidade de soluto é maior que a do solvente.
Solubilidade e temperatura
A solubilidade está relacionada com a temperatura. E, na maioria das substâncias, há um aumento da solubilidade com o aumento da temperatura.

Conforme o gráfico acima, podemos observar que as solubilidades do nitrato de potássio (KNO3), do cromato de potássio (K2CRO4) e do cloreto de sódio (NaCl) aumentam com a elevação da temperatura. Já o sulfato de césio (Ce2(SO4)3) tem sua solubilidade diminuída com o aumento da temperatura.
Curva de solubilidade
A variação dos coeficientes de solubilidade das substâncias em função da temperatura é expressa em gráficos denominados de curvas de solubilidade. Estes gráficos ajudam a determinar a saturação das soluções.

Assim podemos entender que:
- Solução saturada representa qualquer ponto em cima da curva de solubilidade
- Solução insaturada representa qualquer ponto abaixo da curva de solubilidade.
- Solução supersaturada representa qualquer ponto acima da curva de solubilidade.
Exercício resolvido
Vamos resolver um exercício juntos para entender melhor o conteúdo:
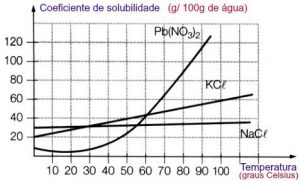
De acordo com esse gráfico vamos responder:
a) qual é o sal que a solubilidade sofre um maior efeito da temperatura no intervalo de 60ºC a 100ºC?
Resposta: Entre 60°C e 100°C é possível ver que a curva do Pb(NO3)2 sofre uma grande alteração. A sua solubilidade aumenta com a temperatura.
b) qual é o sal que a solubilidade sofre um menor efeito de temperatura no intervalo de 60ºC a 100ºC?
Resposta: NaCl, sua solubilidade aumenta muito pouco com a variação de temperatura.
c) qual é a temperatura em que o NaCl e o KCl apresentam a mesma solubilidade?
Resposta: 30ºC quando ambas se cruzam.
Concentração das soluções
A concentração das soluções químicas está relacionada com a quantidade de soluto e de solvente presente em uma solução química. Para ser calculada, usamos a fórmula:
C = massa do soluto / volume da solução
Sendo sua unidade em g/L ( a massa é medida em gramas e o volume em litros).
Exercício resolvido
Vamos resolver outro exercício para entender sobre concentração?
(UFRGS – RS) Um aditivo para radiadores de automóveis é composto de uma solução aquosa de etilenoglicol. Sabendo que em um frasco de 500ml dessa solução existem cerca de 5 mol de (C2H6O2) etilenoglicol, a concentração comum dessa solução em g/L é:
Dados: massas molares (g/mol): H = 1; C =12; O = 16
a) 0,010
b) 0,62
c) 3,10
d) 310
e) 620
Resolução:
Calcular a massa do etilenoglicol:
C = 12. 2 = 24
O = 16. 2 = 32
H = 1. 6 = 6
Total = 62g/mol
Calcular a massa do soluto:
1 mol ——- 62
5 mol ——- x
x = 310g
Calcular a concentração:
transformar 500 ml em L → 0,5L

C = 620 g/L
Videoaula
Vamos agora assistir uma aula do nosso canal no youtube para entender melhor as soluções químicas?
Exercícios
Agora vamos aos nossos exercícios de soluções químicas:
1) (PUC-SP) O gráfico abaixo indica as curvas de solubilidade de quatro diferentes sais:

Qual destes sais apresenta maior solubilidade a 40oC?
a) NaClO3
b) KNO3
c) NH4Cl
d) NaCl
Gabarito: A
2) (UFMG) Seis soluções aquosas de nitrato de sódio (NaNO3), numeradas de I a VI, foram preparadas em diferentes temperaturas dissolvendo-se diferentes massas de NaNO3 em 100 g de água. Em alguns casos, o NaNO3 não se dissolveu completamente. Este gráfico representa a curva de solubilidade de NaNO3 em função da temperatura. Os seis pontos correspondem aos sistemas preparados:

A partir da análise desse gráfico, é CORRETO afirmar que os dois sistemas em que há precipitado são:
a) I e II
b) I e III
c) IV e V
d) V e VI
Gabarito: B (quando as soluções apresentam quantidade de soluto acima da saturação, há presença de precipitado).
3) (PUC-MG) – O gráfico representa as curvas de solubilidade de alguns sais em água.

De acordo com o gráfico, podemos concluir que:
a) a substância mais solúvel em água a 40 °C é o nitrito de sódio.
b) a temperatura não afeta a solubilidade do cloreto de sódio.
c) o cloreto de potássio é mais solúvel que o cloreto de sódio à temperatura ambiente.
d) a massa de clorato de potássio capaz de saturar 200 mL de água, a 30 °C, é de 20 g.
Gabarito: D





