Eletroquímica: como funcionam as pilhas e baterias
Saiba tudo sobre a produção de energia elétrica nas reações químicas para gabaritar nas questões de Eletroquímica. Resumo com exemplos e exercícios de Química Enem.
Muitos dos equipamentos eletrônicos que utilizamos no nosso dia a dia funcionam a pilha ou a bateria. Ambos são sistemas que produzem energia elétrica por meio de reações químicas. O funcionamento de pilhas e baterias é estudado pela eletroquímica.
O que é eletroquímica
A eletroquímica é um ramo da Química que estuda o fenômeno da transferência de elétrons para a transformação de energia química em energia elétrica e vice-versa.
Que tipo de reação química ocorre em uma pilha ou bateria?
Nesses equipamentos acontecem processos que envolvem transferência de elétrons. Esses processos são as reações de oxirredução. Essas reações são espontâneas e por isso pilhas e baterias são capazes de gerar energia elétrica, ou seja, a energia produzida nessas reações químicas transforma-se em energia elétrica.
Veja como tudo acontece no resumo da professora Larissa Marques, do canal do Curso Enem Gratuito:
O esquema a seguir mostra um dispositivo para obtenção de corrente elétrica a partir da reação de oxidação do zinco e redução dos íons cobre (II) em solução aquosa, conhecido como pilha de Daniell. As placas de zinco e de cobre são os eletrodos da pilha.
Chamamos de ânodo o eletrodo que ocorre a oxidação e de cátodo o eletrodo no qual ocorre a redução.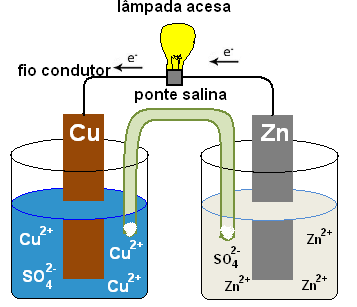 Os processos que ocorrem em cada béquer (semicélula) podem ser representados assim:
Os processos que ocorrem em cada béquer (semicélula) podem ser representados assim:
Ânodo (-): Zn(s) → Zn+2 (aq) + 2é (semireação de oxidação)
Cátodo (+): Cu2+(aq) + 2é → Cu(s) (semireação de redução)
À medida que a pilha vai funcionando, há gasto da lâmina de zinco, que se oxida, com o consequente aumento da concentração de Zn+2 em solução. No outro eletrodo, temos a deposição de cobre, devido à redução de íons Cu+2.
A soma das equações de semireação, resulta na equação global da pilha:
Zno(s) + Cu2+(aq) ↔ Cuo(s) + Zn2+(aq)
Uma maneira prática de representar o esquema de uma pilha é o diagrama da pilha. Para o caso da pilha de Daniell seria:

Potencial padrão de redução
A diferença de potencial (ddp) ou tensão elétrica de uma pilha indica a tendência de ocorrer a reação de oxirredução entre as espécies presentes nas células eletroquímicas. Quanto maior e diferença de potencial de uma pilha, maior a tendência de ocorrer a reação de transferência de elétrons.
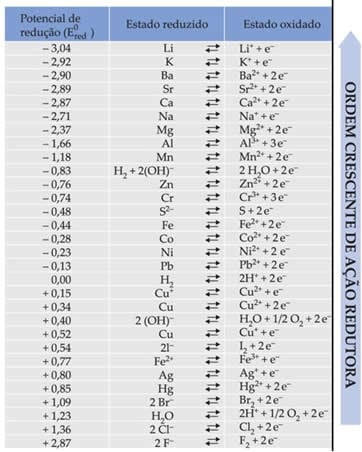
Essa ddp, está relacionada à tendência de oxidação do agente redutor e à tendência de redução do agente oxidante. Assim, se for fixado um eletrodo de referência, pode-se comprara o potencia de cada espécie para oxidar-se ou reduzir-se. A semicélula escolhida para comparação é o eletrodo padrão de hidrogênio.
Convencionou-se que o potencial de semireação, tanto de redução como de oxidação do hidrogênio é de 0,00V. Assim, utilizando o eletrodo padrão de hidrogênio como referência, determina-se o potencial de redução de cada espécie.
A tabela abaixo mostra os potenciais de redução de diversas semicélulas padrão.
Fique ligado(a)!
A IUPAC (União Internacional da Química Pura e Aplicada) aconselha que se trabalhe preferencialmente com potencial-padrão de redução e não o de oxidação.
As pilhas são dispositivos que funcionam a partir de reações espontâneas. A análise da tabela de potenciais padrão de redução, nos ajuda a prever se uma reação de oxirredução é espontânea ou não. Reações espontâneas apresentam Eode reação positivo.
Reveja também outro assunto muito importante para a prova do Enem e dos vestibulares que é Reações de oxidação.
Resumo sobre eletroquímica
Reforce ainda mais o conteúdo de eletroquímica assistindo ao resumo em vídeo do professor Felipe Sobis que preparamos especialmente para você!
Exercícios
Para finalizar sua revisão, veja os exercícios sobre cálculos estequiométricos que selecionamos para você!
1. (PUC – MG) As pilhas de mercúrio são muito utilizadas em relógios, câmaras fotográficas, calculadoras e aparelhos de audição. As reações que ocorrem durante o funcionamento da pilha são:
Zn + 2OH- → ZnO + H2O + 2e
HgO + H2O + 2e → Hg + 2OH-
Sobre essa pilha, assinale a afirmativa INCORRETA:
a) O HgO funciona como ânodo da pilha;
b) O zinco metálico é o agente redutor;
c) A reação se realiza em meio alcalino;
d) O zinco sofre um aumento do seu número de oxidação;
e) O oxigênio não varia seu número de oxidação.
2. (UFMG) Um fio de ferro e um fio de prata foram imersos em um mesmo recipiente contendo uma solução de sulfato de cobre (II), de cor azul. Após algum tempo, observou-se que o fio de ferro ficou coberto por uma camada de cobre metálico, o de prata permaneceu inalterado e a solução adquiriu uma coloração amarelada.
Com relação a essas observações, é CORRETO afirmar que:
a) a oxidação do ferro metálico é mais fácil que a do cobre metálico.
b) a solução ficou amarelada devido à presença dos íons Cu2+.
c) a substituição do sulfato de cobre (II) pelo cloreto de cobre (II) não levaria às mesmas observações.
d) o cobre metálico se depositou sobre o ferro por este ser menos reativo que a prata.
Gabarito:
1. a
2. a





