Corrente elétrica, pilhas e eletroquímica estão muito presentes no nosso dia-a-dia, mas você sabe o que elas significam e como funcionam? Fique nessa aula de Química para se preparar para o Enem!
O que é eletroquímica?
A eletroquímica estuda o aproveitamento prático do fenômeno de transferência de elétrons entre diferentes substâncias para converter a energia química em energia elétrica e vice-versa.
É importante anotar que a conversão da energia química para elétrica tem diferenças em relação a reação inversa (transformação da energia elétrica em energia química). Isso porque a transformação da energia química em energia elétrica é considerada um processo espontâneo e conhecido como Pilha ou Célula Galvânica.
Já a conversão da energia elétrica para a energia química é considerada um processo não espontâneo conhecido como eletrólise.
Sabendo disso, é importante que você saiba que um conteúdo da eletroquímica que o Enem gosta de abordar são as pilhas. Então vamos ver o que elas são?
Pilhas na eletroquímica
As pilhas são aparelhos com componentes metálicos na sua estrutura. A partir das reações de oxidação e de redução dos componentes metálicos, as pilhas apresentam a capacidade de produzir corrente elétrica. Em uma pilha, os elétrons partem de um componente e chegam até outro, formando essa corrente elétrica. É assim que as pilhas fazem funcionar diversos aparelhos eletrônicos.
Para entender como as pilhas na eletroquímica funcionam é necessário relembrar um pouquinho a oxidação e a redução.
Oxidação e redução
A oxidação é a capacidade que um material apresenta de perder elétrons. Já a redução é a capacidade que um material apresenta de ganhar elétrons (cuidado para não achar que por se chamar “redução” ele perderá elétrons, é justamente o contrário!). Os átomos apresentam cargas positivas (cátions) e cargas negativas (ânions), onde estes elementos doam e recebem elétrons para adquirir estabilidade química.
Número de oxidação (Nox)
O número de oxidação (Nox) equivale ao número de elétrons que o átomo ganhou ou perdeu na reação química, ou seja, ele está relacionado à capacidade do átomo para atrair elétrons quando ligado a outro átomo. O número de oxidação varia conforme cada elemento químico:
a) Nox de toda substância simples vale zero;
b) Nox da substância inteira vale zero, ou seja, somando as cargas de todos os elementos, o resultado será zero;
c) Nox do íon é a própria carga.

Como calcular o Nox
Podemos citar 2 exemplos de como calcular o número de oxidação:
a) H2SO4
H = +1
S = x
O = -2
Assim ficamos com a equação → 2 + x – 8 =0
x = 6
b) (SO4) -²
S = x
O = -2
→ x – 8 = -2
x = 6
A oxidação representa a perda de elétrons com aumento do número de oxidação. Nessa reação os elétrons se encontram nos produtos:
X0 → X+² + 2 e–
Al0 → Al+³ + 3 e–
A redução representa o ganho de elétrons com diminuição do número de oxidação. Nessa reação, os elétrons estão nos reagentes:
Y+³ + 3e– → Y0
Cu+² + 2e– → Cu0
Como funcionam as pilhas na eletroquímica
Bom, como já vimos, as pilhas são sistemas em que a energia química é transformada em energia elétrica de modo espontâneo. Seu funcionamento ocorre pela transferência de elétrons de um metal que tem a tendência de ceder elétrons para um que tem a tendência de ganhar elétrons, por meio de reações de oxido-redução.
Cátodo, ânodo e condutor
É importante saber a nomenclatura que se refere às pilhas na eletroquímica. Uma pilha qualquer é formada por um ânodo, que é o polo negativo da pilha (ou seja, sofre o processo de oxidação com perda de elétrons); um cátodo, que é o polo positivo da pilha (sofre o processo de redução, ou seja, recebe os elétrons) e por um condutor de elétrons, material por onde os elétrons percorrem o caminho do ânodo até o cátodo.
A pilha de Daniell
Vamos compreender como ocorre o funcionamento de uma pilha usando como exemplo a pilha de Daniell. Em 1836, o químico e meteorologista inglês John Frederic Daniell (1790-1845) construiu uma pilha diferente, substituindo as soluções ácidas utilizadas por Alessandro Volta (1745-1827), que produziam gases tóxicos, por soluções de sais, tornando as experiências com pilhas menos arriscadas.
A pilha de Daniell funcionava a partir da interligação de dois eletrodos. Cada eletrodo consistia em um sistema formado por um metal imerso em uma solução aquosa. Essa solução aquosa de um sal era formada pelos cátions do metal do eletrodo. Você pode entender melhor com o esquema abaixo que mostra os dois eletrodos da pilha. Essa pilha criada por Daniell estabelecia um equilíbrio dinâmico entre o metal e o cátion da solução aquosa.
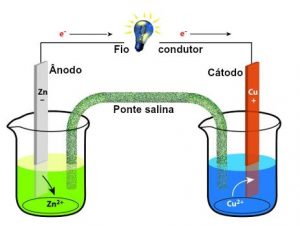
Na pilha de Daniell temos um ânodo de zinco (formado por uma placa) imerso na solução formada por água e sulfato de zinco (ZnSO4). A placa de zinco começa a sofrer oxidação e por conta disso libera elétrons, formando o cátion Zn+². Esse cátion permanece ali na solução, gerando um excesso de cátions, reduzindo o seu tamanho.
Já o cátodo de cobre é formado por uma placa imersa em uma solução contendo água e sulfato de cobre (CuSO4). Na solução há cátions cobre (Cu+), os quais, ao receber os elétrons vindos do ânodo, transformam-se em cobre sólido e ficam aderidos à placa. A placa tem seu tamanho aumentado e a solução fica com deficiência de cátions.
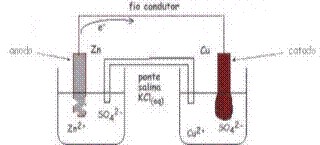
Um fio condutor conecta o ânodo ao cátodo. A ponte salina é formada por uma solução de água e um sal, que pode ser o cloreto de potássio (KCl), que possui cátions (K+) e ânions (Cl–). Durante o funcionamento da pilha, os cátions da ponte salina deslocam-se para a solução do cátodo, e os ânions da ponte salina deslocam-se para a solução do ânodo.
O esquema da pilha acima funcionou pois o metal mais reativo transferiu seus elétrons para o cátion do metal menos reativo.
Sabendo que o zinco é mais reativo que o cobre, Daniell percebeu que o zinco metálico iria transferir seus elétrons para o cátion cobre, Cu+², em vez de transferi-los para o cátion zinco, Zn+². Assim ocorre a passagem de corrente elétrica pelo fio condutor.
Agora vamos ver a reação do que ocorre no ânodo. O polo negativo da pilha é o eletrodo de onde saem os elétrons, no qual ocorre oxidação. No esquema acima, o zinco metálico da placa doa 2 elétrons que correm pelo fio condutor em direção ao eletrodo de cobre e se transforma em cátion zinco, Zn+², que passa a fazer parte da solução:
Zn(s) → (oxidação) 2 e– + Zn+²(aq)
O cátodo ou polo positivo da pilha é o eletrodo para onde vão os elétrons, no qual ocorre redução. No esquema, o cátion cobre, Cu+², que estava em solução, recebe os 2 elétrons doados pelo zinco que vieram pelo fio condutor até a placa de cobre e se transforma em Cu(s), que passa a fazer parte da placa metálica.
Cu+²(aq) + 2e– →(redução) Cu(s)
A reação global da pilha é a soma das reações parciais de cada eletrodo:
Zn(s) → 2 e– + Zn+²(aq)
+
Cu+²(aq) + 2 e– → Cu(s)
______________________________________
Zn(s) + Cu+²(aq) → Zn+²(aq) + Cu(s)
Ponte salina
Na pilha de Daniell ocorre variação de massa. No ânodo a placa de zinco diminui de massa ao mesmo tempo em que a concentração de cátions zinco em solução aumenta.
Já no cátodo a placa de cobre aumenta de massa ao mesmo tempo em que a concentração de cátions cobre em solução diminui.
Nesse processo, as soluções de ambos os eletrodos vão perdendo a neutralidade elétrica e interromperiam o funcionamento da pilha, se não fosse adaptada ao sistema uma ponte salina.
A ponte salina é constituída de um tubo de vidro em formato de U, contendo uma solução aquosa concentrada de um sal bastante solúvel, normalmente o cloreto de potássio (KCl) ou o nitrato de amônio (NH4NO3).
A função da ponte salina é permitir a migração de íons de uma solução para a outra, de modo que o número de íons positivos e negativos na solução de cada eletrodo permaneça em equilíbrio.
Por convenção denominamos o fio condutor por onde passam os elétrons de circuito externo. Nesse, os elétrons partem do ânodo para o cátodo. Denominamos a ponte salina da pilha por onde passam os íons de circuito interno. Nesse, os ânions migram para o ânodo e os cátions migram para o cátodo.
Podemos adaptar um voltímetro nas pilhas, conseguindo medir indiretamente a intensidade da corrente elétrica (ou força eletromotriz). Essa força eletromotriz pode ser expressa em termos de potencial de redução ou potencial de oxidação, em que, para o equilíbrio:
metal ↔ cátion + elétron
O valor do potencial de redução do metal é igual ao potencial de oxidação do cátion, com o sinal trocado. Quanto menor o potencial-padrão de redução, maior a capacidade que o metal possui em doar elétrons e vice-versa. Quanto menor o potencial-padrão de oxidação, maior a capacidade que o cátion possui em receber elétrons e vice-versa.
Há um potencial padrão (ou normal, em 25ºC, pressão de 1 atm, concentração de 1,0 mol/L) que é identificado pelo símbolo: E0. A diferença de potencial (ddp) de uma pilha nessas condições é representada por delta ΔE0 e pode ser calculado:
ΔE0 = E0 red maior – E0 red menor
ΔE0 = E0 oxid maior – E0 oxid menor
Exercício resolvido sobre pilhas
Na pilha de Daniell, o potencial de redução do zinco é -0,76 e o potencial de redução do cobre é +0,34. Assim, o valor da ddp dessa pilha será:
Zn+²(aq) + 2 e– ↔ Zn(s) Ered = – 0,76
Cu+²(aq) + 2 e– ↔ Cu(s) Ered = + 0,34
ΔE0 = E0red maior – E0red menor
Portanto: EredCu+2 – EredZn+2
ΔE0 = + 0,34 – (- 0,76)
Assim, nosso resultado final é 1,10V.
O funcionamento de uma pilha depende de conectarmos metais com diferentes capacidades de sofrer oxidação. Quanto maior a diferença de potencial (ddp) dos eletrodos de uma pilha, maior será a intensidade de corrente elétrica produzida e, portanto, maior a força eletromotriz.
Há outros fatores que influenciam na diferença de potencial. Além dos metais que constituem os eletrodos, as concentrações das soluções utilizadas e a temperatura irão influenciar na diferença de potencial de uma pilha. Então, a variação de temperatura sempre irá provocar variação no ddp da pilha, aumentando ou diminuindo a força eletromotriz, conforme os eletrodos envolvidos.
E segundo o princípio de Le Chatelier, quanto mais concentrada for a solução de sulfato de cobre e quanto mais diluída for a solução de sulfato de zinco, maior será o potencial das pilhas na eletroquímica, pois a reação irá se deslocar no sentido direto.
Videoaula
Para entender melhor como funcionam as pilhas na eletroquímica, assista à videoaula abaixo, com o professor Sobis!
Exercícios sobre pilhas
Agora resolva os exercícios abaixo sobre pilhas na eletroquímica e prepare-se para o Enem!
1) (UCS-BA) O pólo positivo de uma pilha eletroquímica é o eletrodo onde há semi-reação de:
a) oxidação, ou seja, ganho de prótons
b) oxidação, ou seja, perda de elétrons
c) redução, ou seja, ganho de prótons
d) redução, ou seja, ganho de elétrons
e) redução, ou seja, perda de elétrons
Gabarito: D
2) (PUC-MG) Na célula eletroquímica, representada pela equação global:
2 Ag+(aq) + Ni(s) → Ni+²(aq) + 2 Ag(s)
é correto afirmar que:
a) os elétrons fluem, pelo circuito externo, da prata para o níquel
b) a solução de níquel irá diluindo-se
c) há desgaste do eletrodo de prata
d) a prata sofre redução
e) o níquel é o cátodo
Gabarito: D
3) (FUVEST-SP) Em uma pilha do tipo encontrado em supermercados, o pólo negativo é constituído pelo revestimento externo de zinco. a semi-reação que permite ao zinco funcionar como pólo negativo é:
a) Zn+²(aq) + e– → Zn(s)
b) Zn+²(aq) + 2 e– → Zn(s)
c) Zn(s) → Zn+(aq) + e–
d) Zn+²(aq) + Zn(s) → 2 Zn+(aq)
e) Zn(s) → Zn+²(aq) + 2 e–
Gabarito: E
4) (CESGRANRIO-RJ) Dados os potenciais-padrão de redução:
Al+³ + 3 e– → Al (- 1,66V)
Fe+² + 2 e– → Fe (- 0,44 V)
A ddp da pilha Al; Al+³; Fe+²; Fe, em condições-padrão é:
a) 2,10V
b) 1,32V
c) 1,22V
d) 1,08V
e) 0,88V
Gabarito: C

