Eletroquímica – Simulado de Química
Com o simulado Enem sobre Eletroquímica você testa seus conhecimentos e se prepara para a prova. São apenas 10 questões para você estudar e garantir dicas se errar.
A eletroquímica é um tema que assusta pelo nome, mas que não precisa ser um obstáculo tão grande em seus estudos. Entenda melhor o assunto e aprenda como funcionam as pilhas com a aula da professora Larissa!
Muito bem! Agora você está preparado para testar seus conhecimentos no simulado. Os exercícios vão lhe ajudar a fixar a aula em sua memória!
Eletroquímica – Simulado de Química
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(Mackenzie SP/2018)
De acordo com os conceitos de eletroquímica, é correto afirmar que
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 2 de 10
2. Pergunta
(UEMG/2016)
A eletroquímica é uma área da química com grande aplicação industrial, dentre elas, destacam-se a metalúrgica e a área de saneamento. Na metalurgia extrativa, utiliza-se um metal como agente redutor para obtenção de outro no estado elementar. Já na área de saneamento, o tratamento de águas residuarias utiliza o processo químico descrito para transformar um composto químico em outro por meio da aplicação de uma corrente elétrica através da solução.
Considere os seguintes potenciais de redução descritos abaixo:
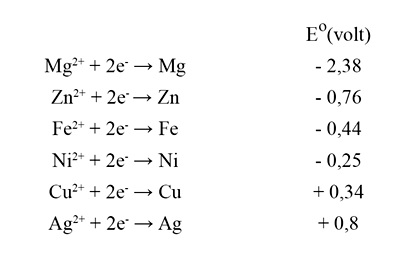
O par de compostos que poderia ser utilizado na metalurgia extrativa, bem como o nome do processo aplicado na área de saneamento, está CORRETAMENTE descrito na opção:
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 3 de 10
3. Pergunta
(UNIRG TO/2014)
Uma célula eletroquímica foi construída baseada nas semirreações apresentadas a seguir.
 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 4 de 10
4. Pergunta
(UDESC SC/2014)
Analise as proposições em relação a um experimento de eletroquímica.
I. Em uma reação de óxidorredução que ocorre espontaneamente, os elétrons são transferidos de uma espécie química com maior potencial de redução para outra com menor potencial de redução. Portanto, ao calcularmos a diferença de potencial da célula, chega-se a um valor positivo.
II. Uma medida de potencial eletroquímico considera o uso de um eletrodo padrão de hidrogênio (EPH). Se a semicela H+/H2 atuar como ânodo, a semirreação será a de oxidação de H2 a H+ e, se atuar como cátodo, será a de redução de H+ a H2.
III. Uma das formas de evitar o acúmulo de cargas elétricas nas soluções catódicas e anôdicas é o uso de uma ponte salina. O excesso de ânions ou cátions gerados nas reações eletroquímicas é compensado pela migração de íons provenientes da ponte salina.
Assinale a alternativa correta.
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 5 de 10
5. Pergunta
(UNCISAL/2014)
As pilhas ou células eletroquímicas presentes no nosso cotidiano são utilizadas em brinquedos, equipamentos eletrônicos, relógios etc. São dispositivos que transformam energia química em energia elétrica por meio de reações de oxirredução espontâneas. O esquema representa uma célula eletroquímica.
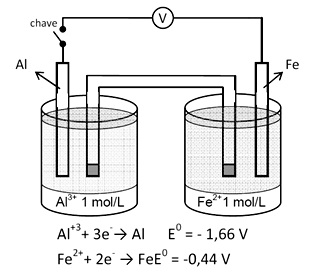
Sobre essa célula, constata-se que
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 6 de 10
6. Pergunta
(UECE/2014)
 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 7 de 10
7. Pergunta
(UFRGS RS/2014)
Células eletroquímicas podem ser construídas com uma ampla gama de materiais, até mesmo metais nobres como prata e ouro.
Observe, abaixo, as semirreações de redução.
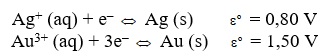
Assinale com V (verdadeiro) ou F (falso) as seguintes afirmações a respeito de uma célula eletroquímica, constituída de ouro e prata.
( ) Um dos eletrodos poderia ser construído com ouro em água pura; e o outro, prata em água pura.
( ) Uma pilha construída com placas metálicas de ouro e prata, em contato com os respectivos sais, teria força eletromotriz padrão de 0,70 V.
( ) Essa célula eletroquímica produz aumento da massa do ouro metálico.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 8 de 10
8. Pergunta
(UNICAMP SP/2018)
A galvanoplastia consiste em revestir um metal por outro a fim de protegê-lo contra a corrosão ou melhorar sua aparência. O estanho, por exemplo, é utilizado como revestimento do aço empregado em embalagens de alimentos. Na galvanoplastia, a espessura da camada pode ser controlada com a corrente elétrica e o tempo empregados. A figura abaixo é uma representação esquemática desse processo.
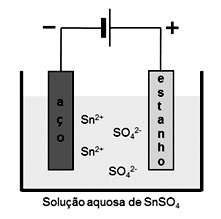
Dados: 1 mol de elétrons corresponde a uma carga de 96.500 C; Sn: 119 g.mol–1.
Considerando a aplicação de uma corrente constante com intensidade igual a 9,6510–3 A, a massa depositada de estanho após 1 min 40 s será de aproximadamente
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 9 de 10
9. Pergunta
(UDESC SC/2018)
 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 10 de 10
10. Pergunta
(FMABC SP/2018)
Considere o seguinte sistema utilizado na purificação de cobre metálico.
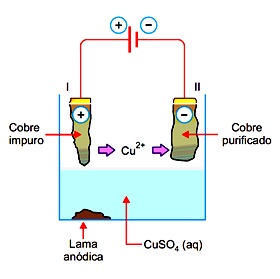
Nesse processo
CorretoParabéns! Siga para a próxima questão.
Sobre o(a) autor(a):
Taynara Macedo -
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


