As reações químicas (rearranjos de átomos) ocorrem em nosso cotidiano e envolvem perda ou ganho de calor (energia), como o cozimento dos alimentos, a fotossíntese realizada pelas plantas ou quando detonamos um explosivo. Esses exemplos são reações que absorvem energia.
As reações que liberam energia também ocorrem em nosso dia a dia, como a queima de carvão e da vela, a queima da gasolina no carro ou a reação química em uma pilha. Então venha estudar conosco termoquímica e entalpia para se preparar para a prova de Química do Enem!
O que é entalpia?
A termoquímica estuda as quantidades de calor liberadas ou absorvidas durante as reações químicas. Ela também é observada na transferência de energia em alguns fenômenos físicos, como nas mudanças de estados físicos.
O calor é uma energia em movimento, sendo uma das formas de energia mais conhecida. Nas reações químicas, pode ocorrer absorção ou liberação de energia. A transferência de calor é feita do corpo que tem a temperatura mais alta para aquele que tem a temperatura mais baixa.
Em uma reação, a energia armazenada proveniente da interação das ligações químicas dos reagentes transformando-se em produtos, é chamada de entalpia (H). Para calcular a variação de entalpia em uma certa reação química, deve-se realizar a diferença entre a entalpia dos produtos e dos reagentes.
Calor liberado ou absorvido em uma reação
Já o calor de uma reação corresponde ao calor liberado ou absorvido nesta mesma reação, e é representado por ΔH.
A + B → C + D
(Reagentes) → (Produtos)
ΔH = Hfinal – Hinicial
Ou seja
ΔH = Hprodutos – Hreagentes
A unidade de medida mais utilizada para representar o calor é a caloria (cal), porém, no Sistema Internacional (SI), usamos o Joule. Assim, podemos usar como unidade de referência:
1 cal = 4,18J (Joules)
1 kcal = 1000 cal (calorias)
Reações endotérmicas
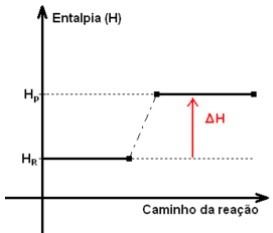
Em uma reação química quando há absorção de energia na forma de calor, essa reação é denominada endotérmica.
A + B + calor → C + D
(Hr = entalpia dos reagentes) → (Hp = entalpia dos produtos)
A energia total se conserva do primeiro para o segundo membro de qualquer reação química. Em uma reação endotérmica, a entalpia dos produtos é maior que a entalpia dos reagentes, pois uma quantidade de energia foi absorvida na forma de calor pelos reagentes, ficando contida nos produtos. Assim, temos:
Hr < Hp
ΔH = Hprodutos – Hreagentes
Uma vez que a Entalpia dos produtos é maior que a dos reagentes, o ΔH será maior que zero. Assim ΔH > 0.
Exemplo
Como exemplo de equação endotérmica (representa a reação química) podemos ter:
½ N2(g) + ½ O2(g) → NO(g) ΔH = + 90 KJ/mol
½ N2(g) + ½ O2(g) + 90 KJ → NO(g)
½ N2 (g) + ½ O2(g) → NO(g) – 90 KJ
Como exemplo de reação endotérmica em nosso cotidiano podemos citar a gordura corporal que não é queimada pelo nosso organismo, mas sim absorvida por ele. Outro exemplo acontece quando passamos álcool no corpo, inicialmente ocorre um certo calor, mas se soprarmos o local, sentimos frio, pois o álcool aquece o local e depois é liberado para o ambiente.
Outro exemplo de reação endotérmica é a mudança de estado sólido para o líquido e do estado líquido para o estado gasoso.
Reações exotérmicas
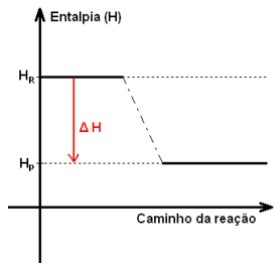
Quando uma reação química libera energia na forma de calor, ela é denominada exotérmica.
A + B → C + D + calor
(Hr) → (Hp)
A entalpia dos produtos é menor que a entalpia dos reagentes, pois uma parte da energia que estava contida nos reagentes foi liberada na forma de calor, quando eles se transformaram em produtos.
Hr > Hp
ΔH = Hp – Hr
Portanto, ΔH < 0.
Exemplo
Como exemplo de reação exotérmica podemos ter:
C(graf) + O2(g) → CO2(g) ΔH = – 394 KJ/mol
C(graf) + O2(g) → CO2(g) + 394 KJ (libera calor)
C(graf) + O2(g) – 394 kj → CO2
Numa reação exotérmica, temos uma sensação de aquecimento. Como por exemplo, em um acampamento, as pessoas ficam junto de uma fogueira para que o calor liberado pelas chamas aqueça todos.
Outro exemplo de reação exotérmica é a mudança do estado gasoso para o líquido e do estado líquido para o estado sólido.
Para entender as transformações físicas e suas respectivas reações:
reação exotérmica ← (libera calor do gasoso para líquido e do líquido para o sólido)
H2O (sólido) ——- H2O (líquido) ———- H2O (gasoso)
reação endotérmica → (absorve calor de sólido para líquido e de líquido para gasoso)
Tipos de entalpia
Entalpia de Formação
A entalpia de formação (Hº) é a energia (calor) da reação quando forma 1 mol de substância a partir das substâncias simples. Ou seja, representa o calor que foi liberado ou absorvido na reação de formação de 1 mol de certa substância, a partir de substâncias simples no estado padrão (25ºC e 1 atm). Para as substâncias simples no estado padrão, a entalpia de formação (Hfº) é igual a zero. Como exemplo temos:
O2(g): H = 0
O3: H ≠ 0
Exemplo
Vamos fazer um exemplo? A reação de formação do ácido sulfúrico a partir de substâncias simples no estado padrão:
H2(g) + S(rômbico) + 2 O2(g) → H2SO4 ΔH = – 813,8KJ
Como falamos acima, a entalpia padrão será igual a zero:
ΔHº = Hprodutos – Hreagentes
– 813,8 = HH2SO4 – (HH2 + HS + HO2)
– 813,8 = HH2SO4 – 0
HH2SO4 = – 813,8 kj/mol
Calcular o valor da entalpia de formação do SO3s):
Dados: HºSO3 = – 396 kj/mol
S(s) + 3/2 O2(g) → 1 SO3 (g)
ΔHº = Hproduto – Hreagente
ΔHº = – 396 – (0 + 0)
ΔHº = -396 KJ/mol
Para entender melhor como calcular a entalpia de formação, veja a videoaula do professor Sobis:
Entalpia de combustão
A entalpia de combustão é uma reação exotérmica e representa o calor liberado na reação de combustão de 1 mol de uma substância em presença de gás oxigênio (O2).
A combustão completa origina gás carbônico e água. Como no exemplo:
1 C2H5OH (l) + 3 O2 (g) → 2 CO2(g) + 3 H2O(l) ΔHcomb = – 1367 KJ/mol
A combustão incompleta produz menos energia e forma o monóxido de carbono (CO), água e carbono fuligem. Como no exemplo:
1 C2H5OH(l) + 2 O2(g) → 2 CO(g) + 3 H2O(l) ΔHcomb= – 801 kj/mol
Exemplo
Vamos fazer um exemplo?
Calcular o valor da entalpia de combustão do benzeno (C6H6).
Dados:
C6H6 (g) = + 80 KJ/mol
CO2(g) = – 400 KJ/mol
H2O(l) = – 240 KJ/mol
C6H6 (g) + 15/2 O2(g) → 6 CO2(g) + 3 H2O(l) ΔHcomb = ?
ΔHcomb = Hp – Hr
ΔHcomb = [6.( – 400) + 3. (- 240) ] – (+ 80) + 15/2 . 0
ΔHcomb = – 2400 – 720 – 80
ΔHcomb = – 3200 KJ/mol
Entalpia de ligação
A entalpia de ligação é a energia absorvida (endotérmica) na quebra de 1 mol de ligação no estado gasoso a 25ºC e 1 atm.
H2(g) + Cl2(g) → 2 HCl(g)
H—— H + Cl —– Cl → 2 (H —— Cl)
Dados:
H —– H = 436
Cl —– Cl = 242
H —– Cl = – 431
ΔH = 436 + 242 + 2(-431)
ΔH = 678 + (-862)
ΔH= – 184 KJ/mol
Entalpia de neutralização
A entalpia de neutralização é o calor liberado (exotérmico) na neutralização entre um ácido e uma base, formando 1 mol de água líquida a partir da reação entre 1 mol de H+ e 1 mol de OH–, considerando o meio a 25ºC e 1 atm. O ΔH é constante, e equivale a – 57,7 KJ/mol.
H(aq)+ + OH(aq)– → H2O(l) ΔHneutral+ = – 57,7 kj/mol
Lei de Hess
Germain Henry Hess (1802 – 1850), químico e médico suíço, criou a lei de Hess ou a lei da soma dos calores da reação. Esta lei estabelece que a variação de entalpia de uma reação química depende dos estados inicial e final da reação.
ΔH= Hfinal – Hinicial
O valor do ΔH de um processo não depende do número de etapas intermediárias e nem do tipo de reação que ocorre em cada etapa do processo. Assim, calcula-se o ΔH de uma reação X (incógnita), pela soma de reações de ΔH conhecidos, cujo resultado seja a reação X.
Exemplo
Vamos fazer um exemplo para compreender melhor o anunciado acima:
Calcular o valor da variação de entalpia da seguinte reação:
equação X: 2C(graf) + 1 O2(g) → 2 CO (g) ΔH =?
Dadas as seguintes equações intermediárias:
I – 1 C(graft) + 1 O2 (g) → 1 CO2(g) ΔH = – 94,1kcal
II – 2 CO(g) + 1 O2 (g) → 2 CO2(g) ΔH = -135,4 kcal
Assim, temos 2 reações intermediárias que deverão ser alteradas e por último somadas, para podermos chegar na nossa equação X, e depois calcular o delta H da reação.
Etapas para realizar o exercício:
a) Na equação X temos como reagente 2 mol de C(graft). O C(graft) aparece na equação I, porém apenas com 1 mol de C(graft). Então, devemos multiplicar toda a equação I por 2 para obter uma reação em que 2 mol C(graft) sofrem combustão completa. Ao multiplicar ou dividir os coeficientes de uma reação termoquímica por um número qualquer, deve-se multiplicar ou dividir o valor do ΔH dessa reação pelo mesmo número:
equação I multiplicada: = 2 C(graft) + 2O2(g) → 2 CO2(g) ΔH = -188,2 kcal
b) Na equação X temos como produto: 2 mol de CO(g). Na equação II aparecem 2 mol de CO(g) no reagente. Devemos inverter a equação II para obter uma reação em que se formam 2 mol de CO(g). Ao inverter uma reação termoquímica, deve-se trocar o sinal do ΔH, pois se em determinado sentido a reação libera calor, em sentido contrário, a reação terá de absorver a mesma quantidade de calor que havia liberado e vice-versa.
inverso da equação II: 2 CO2(g) → 2 CO(g) + 1 O2(g) ΔH = + 135,4 kcal
c) quando tivermos as mesmas quantidades de reagentes e produtos em sentido inverso das reações podemos eliminá-los da reação final.
Somando as equações I e II, após as regras citadas, iremos obter a equação X:
equação I: 2 C(graft) + 2 O2(g) → 2 CO2(g) ΔH = – 188,2 kcal
equação II: 2 CO2(g) → 2 CO(g) + 1 O2(g) ΔH = + 135,4 kcal
equação X: 2 C(graft) + 1 O2(g) → 2 CO(g) ΔH = – 52,8 kcal
O ΔH da reação X é igual a soma dos valores dos ΔH dessas equações.
Resumo sobre a Lei de Hess
Para melhor entender os procedimentos para realizar exercícios com a Lei de Hess vamos lembrar dos seguintes itens:
- se uma substância aparece na mesma quantidade no reagente de uma equação e no produto de outra equação, a soma será igual a zero.
- se uma substância aparece em maior quantidade no reagente de uma equação e em menor quantidade no produto de outra equação, devemos subtrair essas quantidades e colocar o resultado no reagente da equação final.
- se uma substância aparece em maior quantidade no produto de uma equação e em menor quantidade no reagente de outra equação, devemos subtrair essas quantidades e colocar o resultado no produto da equação final.
- se uma substância aparece no reagente de duas ou mais equações diferentes, devemos somar todas as quantidades e colocar o total no reagente da equação final. O mesmo raciocínio deve ser seguido no caso de uma substância que aparece no produto de duas ou mais equações diferentes.
- se uma substância aparece no reagente ou no produto de apenas uma equação entre as várias que estão sendo somadas, devemos colocar essa substância respectivamente no reagente ou no produto da equação final, na quantidade em que ela se apresenta.
Videoaula sobre como calcular a entalpia
Exercícios
1) (Vunesp-SP-2005)
Em uma cozinha estão ocorrendo os seguintes processos:
I – gás queimando em uma das bocas do fogão e
II – água fervendo em uma panela que se encontra sobre esta boca do fogão.
Com relação a esses processos, pode-se afirmar que:
a) I e II são exotérmicos
b) I é exotérmico e II é endotérmico
c) I é endotérmico e II é exotérmico
d) I é isotérmico e II é exotérmico
e) I é endotérmico e II é isotérmico
2) (Mackenzie-SP)
Fe2O3(s) + 3 C(s) + 491,5 KJ → 2 Fe(s) + 3 CO(g)
Da transformação do óxido de ferro III em ferro metálico, segundo a equação acima, pode-se afirmar que:
a) é uma reação endotérmica
b) é uma reação exotérmica
c) é necessário 1 mol de carbono para cada mol de Fe2O3 (g) transformado
d) o número de mols de carbono consumido é diferente do número de mols de CO produzido
e) a energia absorvida na transformação de 2 mols de Fe2O3 (s) é igual a 491,5 KJ
3) (UFMS-MS)
É correto afirmar que o ΔHº para a reação balanceada:
2 Ag2S(s) + 2 H2O (l) → 4 Ag(s) + 2 H2S (g) + O2 (g)
Considerando os respectivos Hº, em KJ/mol, de H2S (g) = – 20,6; de Ag2S (s) = – 32,6; de H2O (l) = – 285,8 será:
a) 485,6 kj
b) 495,6 kj
c) 585,6 kj
d) 595,6 kj
e) 600,0 kj
4) (UEL-PR-2010)
Sobre a reação:
C3H8(g) + 5 O2(g) → 3 CO2(g) + 4 H2O(l)
Dadas as entalpias de formação de: C3H8 (g) = -24,90 kcal/mol; CO2 (g) = – 94,05 kcal/mol; H2O (l) = – 68,30 kcal/mol. É correto afirmar que o processo é:
a) exotérmico e a energia envolvida é -187,25 kcal
b) endotérmico e a energia envolvida é 530,45 kcal
c) exotérmico e a energia envolvida é – 580,24 kcal
d) exotérmico e a energia envolvida é – 530,45 kcal
e) endotérmico e a energia envolvida é 580,25 kcal
Gabarito:
- B
- A
- D
- D

