Funções inorgânicas: ácidos, bases, classificações e nomenclaturas
As funções inorgânicas são ácidos, bases, sais e óxidos. Elas estão presentes no nosso dia a dia, seja fazendo parte da composição de algum medicamento, produto de limpeza ou até mesmo nos alimentos que comemos!
As substâncias químicas foram divididas em grupos ou funções químicas, que representam conjuntos de substâncias com propriedades semelhantes. As duas principais funções químicas são: as inorgânicas e as orgânicas.
As substâncias orgânicas representam os compostos que têm o carbono como principal elemento constituinte. Elas abrangem os hidrocarbonetos, álcoois, aldeídos, cetonas, ácidos carboxílicos, etc.
Quais são as funções inorgânicas
Já as substâncias inorgânicas, que abordaremos mais a fundo nesta aula, representam os compostos que não possuem o carbono (com algumas exceções). Elas abrangem os ácidos, bases, sais e óxidos.
Em 1887, o sueco Svante August Arrhenius (1859 – 1927) propôs a Teoria de Dissociação Iônica, na qual determinadas substâncias, quando dissolvidas em água, formavam íons positivos e negativos. Este feito rendeu para Arrhenius o Prêmio Nobel em 1903.
A Teoria de Arrhenius estava baseada no comportamento de ácidos e bases em água. Arrhenius observou que certas substâncias, quando colocadas em água, liberavam íons, que deixavam a solução eletrolítica, ou, condutora de eletricidade.
Dissociação Iônica
Ele fez vários experimentos e percebeu que quando colocava compostos iônicos, como o sal de cozinha (NaCl), ocorria condução de corrente elétrica. Concluiu que a passagem de corrente elétrica ocorre porque há íons livres na solução, separados por meio de ligação iônica entre o sódio (Na) que doa elétrons para o cloro (Cl).
NaCl → Na+ + Cl–
Assim, ocorre a dissociação iônica, que ocorre em compostos iônicos, quando os íons que já existiam são separados.
Ca (OH)2 →(em água) Ca2+ + 2 OH–
Arrhenius também realizou experimentos com compostos moleculares, que realizam reações covalentes, como o ácido clorídrico (HCl). Ele observou que estes também produziam soluções eletrolíticas, que também conduziam corrente elétrica.
Nesse composto não existem íons, pois ocorre o compartilhamento de pares de elétrons, porém ocorre a formação do cátion hidrônio (H3O+). Isso porque o oxigênio da água atrai o hidrogênio do HCl, formando o cátion hidrônio.
HCl + H2O → H3O+ + Cl–
Na reação química quando há a formação de íons ocorre o processo de ionização
H2SO4 →(em água) 2H+ + SO42-
Ácidos
Segundo Arrhenius, ácido é toda substância que, em solução aquosa, sofre ionização formando íons H+, como único tipo de cátion.
HCl → (em água) H+ + Cl–
Classificação dos ácidos
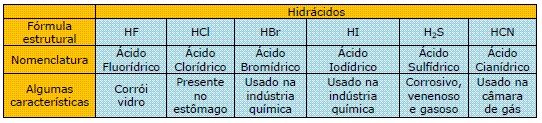
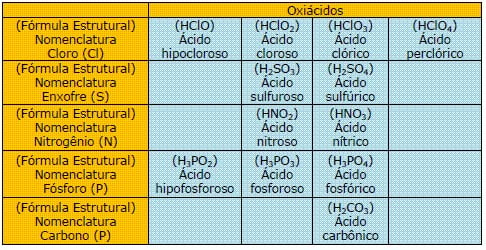
Os ácidos podem ser classificados em hidrácidos (não apresentam átomos de oxigênio em sua composição: HCl, HF) e oxiácidos (possuem átomos de oxigênio em sua composição: HNO3, H2CO3).
Os ácidos também podem ser classificados segundo sua força:

De acordo com a quantidade de hidrogênios que podem sofrer ionização, os ácidos podem ser também classificados em:
a) monoácido: possui um hidrogênio ionizável. Exemplo: HI
b) diácido: possui dois hidrogênios ionizáveis. Exemplo: H2SO3
c) triácido: possui três hidrogênios ionizáveis. Exemplo: H3BO3
e) tetrácido: possui quatro hidrogênios ionizáveis. Exemplo: H4P2O7
Os ácidos apresentam certas propriedades como:
a) possuem sabor azedo
b) formam soluções aquosas condutoras de corrente elétrica
c) reagem com os metais, produzindo gás hidrogênio
d) reagem com carbonatos e bicarbonatos, liberando gás carbônico:
CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
e) mudam a cor de certas substâncias chamadas indicadores: a solução de fenolftaleína fica incolor em meio ácido; o papel de tornassol l fica vermelho em meio ácido.
Nomenclatura dos ácidos
A nomenclatura dos hidrácidos é dada por: palavra ácido + nome do elemento com o sufixo ídrico.
A nomenclatura dos oxiácidos segue a regra do NOX:
| Nome | NOX do elemento central |
| HIPO…..OSO | +1 |
| ………… OSO | +3; +4 |
| ………… iCO | +5; +6 |
| PER…….ICO | +7 |
Saiba mais sobre a definição e a classificação dos ácidos com a videoaula do prof. Sobis
Bases
Segundo Arrhenius, base é toda substância que dissolvida em água se dissocia, formando o ânion hidroxila (OH–)
NaOH → (em água) Na+ + OH–
Nomenclatura das bases
A nomenclatura das bases é representada por:
a) cátion que possui apenas uma carga: usa-se a palavra hidróxido + nome do cátion. Exemplo: NaOH = hidróxido de sódio, Ca(OH)2 = hidróxido de cálcio, AgOH = hidróxido de prata.
b) cátion que possui mais de uma carga: usa-se a palavra hidróxido + nome do cátion de menor carga com a terminação OSO; usa-se a palavra hidróxido + nome do cátion de maior carga com a terminação ICO. Exemplo: Fe(OH)2 = hidróxido ferroso e Fe(OH)3 = hidróxido férrico.
Classificação das bases
As bases podem ser classificadas de acordo com o número de grupos OH– liberados na dissociação de uma base em meio aquoso:
Assim, temos: monobase (KOH); dibase (Mg(OH)2); tribase (Al(OH)3); tetrabase (Sn(OH)4).
As propriedades das bases são bem características:
a) possuem sabor cáustico/adstringente (já tomou leite de magnésia? É aquela sensação esquisita que fica na boca)
b) em solução aquosa, conduzem corrente elétrica
c) reagem com os ácidos, por meio de reações de neutralização, formando um sal e água
d) decompõem-se quando aquecidas
e) atuam sobre a cor dos indicadores ácido-base: a fenolftaleína em meio básico adquire coloração avermelhada ou rosa intensa e o papel de tornassol fica azul em meio básico.
Confira a aula do prof. Sobis sobre bases:
Exercícios sobre funções inorgânicas
Agora vamos testar nossos conhecimentos de funções inorgânicas e realizar alguns exercícios:
1) (PUCCAMP) – A respeito das substâncias denominadas ácidos, um estudante anotou as seguintes características:
I – têm poder corrosivo;
II – são capazes de neutralizar bases;
III – são compostos por dois elementos químicos;
IV – formam soluções aquosas condutoras de corrente elétrica.
Ele cometeu erros SOMENTE em
a) I e II
b) I e III
c) I e IV
d) II e III
e) III e IV
gab.: b
(resolução: nem todos os ácidos são corrosivos, apenas os mais fortes, além de que os ácidos podem ser formados por dois ou mais elementos.)
2) (Vunesp) Os nomes dos ácidos oxigenados a seguir são, respectivamente: HNO2, HClO3, H2SO4, H2SO3, H3PO4:
a) nitroso, clórico, sulfúrico, sulfuroso e fosfórico;
b) nítrico, clorídrico, sulfuroso, sulfúrico e fosfórico;
c) nítrico, hipocloroso, sulfúrico, sulfuroso e fosforoso;
d) nitroso, perclórico, sulfuroso, sulfúrico e fosfórico;
e) nítrico, cloroso, sulfuroso, sulfúrico e hipofosforoso
gab.: a
3) (UFU-MG) Entre os oxiácidos H2SO3, H3BO3, HClO3 e HMnO4, a ordem crescente de força ácida para esses compostos é:
a) H2SO3, HClO3, H3BO3, HMnO4
b) HClO3, HMnO4, H2SO3, H3BO3
c) H3BO3, HClO3, H2SO3, HMnO4
d) H3BO3, H2SO3, HClO3, HMnO4
e) HMnO4, HClO3, H3BO3, H2SO3
gab.: d
4) (ENEM) Grande quantidade dos maus odores do nosso dia a dia está relacionada a compostos alcalinos. Assim, em vários desses casos, pode-se utilizar o vinagre, que contém entre 3,5% e 5% de ácido acético, para diminuir ou eliminar o mau cheiro. Por exemplo, lavar as mãos com vinagre e depois enxaguá-las com água elimina o odor de peixe, já que a molécula de piridina (C5H5N) é uma das substâncias responsáveis pelo odor característico de peixe podre.
SILVA, V. A.; BENITE, A. M. C.; SOARES, M. H. F. B. Algo aqui não cheira bem…
A química do mau cheiro. Química Nova na Escola, v. 33, n. 1, fev. 2011 (adaptado).
A eficiência do uso do vinagre nesse caso se explica pela
a) sobreposição de odor, propiciada pelo cheiro característico do vinagre.
b) reação de neutralização entre o ácido acético e a piridina, que resulta em compostos sem mau odor.
c) degradação enzimática da molécula de piridina, acelerada pela presença de ácido acético.
d) solubilidade da piridina, de caráter ácido, na solução ácida empregada.
e) Inibição da proliferação das bactérias presentes, devido à ação do ácido acético.
gab.: b




