Ligações metálicas: como ocorrem, características e exemplos
Você está habituado a escutar sobre fios de cobre, cabos de aço e o ouro 18 quilates. Mas o que estes elementos estão fazendo no conteúdo da nossa aula? Venha estudar conosco e conhecer mais sobre as ligações metálicas e as ligas metálicas.
As ligações metálicas são ligações químicas que ocorrem entre metais, formando uma estrutura denominada de liga metálica. Está complicado? Lembra onde se localizam os metais na tabela periódica? Vamos recordar!
Os metais na tabela periódica
Os metais fazem parte da família 1A dos metais alcalinos (Lítio, Sódio, Potássio, Césio e Frâncio), da família 2A dos metais alcalinos-terrosos (Berílio, Magnésio, Cálcio, Estrôncio, Bário e Rádio).

Também são encontrados no bloco B da tabela, na categoria dos metais de transição representados pelo ouro, prata, ferro, cromo, manganês, níquel, cobre, zinco, platina, etc.
Os metais são geralmente sólidos a 25ºC e 1 atm. Atenção! A exceção é o mercúrio, que é um metal líquido. Os metais possuem baixa eletronegatividade, e grande tendência a perderem elétrons da última camada, transformando- se em cátions.
Introdução sobre as Ligações Metálicas
Confira agora com a professora Larissa Campos, do canal do Curso Enem Gratuito:
Como você acompanho no vídeo, os átomos de metais possuem de 1 a 3 elétrons na camada de valência, e essa camada se encontra afastada do núcleo atômico, atraindo poucos elétrons.
Com isso, os elétrons têm a facilidade de escapar do átomo e transitar pelo retículo cristalino, que é uma estrutura geométrica formada pelo agrupamento de átomos metálicos.
Nessa movimentação de elétrons, os átomos se transformam em cátions (ao perderem elétrons) ou voltam à forma de átomos neutros (ao ganharem elétrons). Isto descreve a nuvem eletrônica ou o mar de elétrons, que representa um aglomerado de átomos neutros, cátions e elétrons livres.
A ligação metálica é o resultado da interação entre os elétrons livres e os cátions fixos, ou seja, um aglomerado de cátions mergulhados em um mar de elétrons. Esses elétrons são denominados semi livres ou elétrons livres, porque podem se mover dentro da estrutura metálica, mas não podem abandoná-la. É a presença desse mar de elétrons que mantém os cátions unidos.
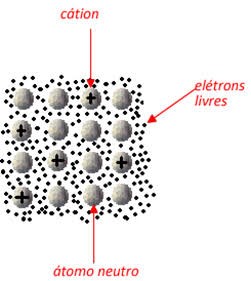
Resuminho: quando os átomos metálicos vão se unir, acabam deixando elétrons. que estavam na camada mais externa de lado. Esses elétrons vão se acumulando, e formam uma nuvem eletrônica, que estabiliza os cátions, por isso o nome de mar de elétrons, devido ao acúmulo desses elétrons livres. São esses elétrons que formarão a ligação metálica.
Além da ligação metálica, os metais podem realizar outro tipo de ligação: a iônica. Essa ligação ocorre quando os metais se relacionam com elementos ametais ou Hidrogênio (H). Nessa relação, os metais perdem elétrons (transformam-se em cátions) e os ametais/Hidrogênio ganham elétrons (transformam-se em ânions).
Exemplos de ligação iônica com metais:
Al2O3 = é o óxido de alumínio. O alumínio é um metal enquanto o oxigênio é um ametal.
FeS = sulfeto de ferro. O ferro é um metal e o enxofre um ametal.
Características dos Metais
A teoria da ligação metálica explica muitas propriedades dos metais como:
- brilho metálico.
- condutividade térmica e elétrica elevadas: ocorre devido a grande mobilidade dos elétrons, que permitem uma transmissão rápida de calor e eletricidade através do metal. como exemplo podemos citar: fios, panela.
- densidade elevada: formam ligações muito organizadas e próximas, com volume pequeno e com certa massa, determinando uma densidade elevada.
- pontos de fusão (temperatura para passar do estado sólido para o estado líquido) e ponto de ebulição (temperatura para passar do estado líquido para o estado gasoso): a força de atração causada pelo mar de elétrons é muito forte, mantendo os átomos unidos com muita intensidade.Assim, para que se rompa essa ligação é preciso fornecer altas energias externas. Essa é uma característica que permite o uso dos metais em caldeiras, tachos e reatores nucleares, onde ocorrem aquecimentos intensos e eles não derretem.
- resistência à tração: ela é decorrente da força com que a ligação metálica mantém os átomos unidos. os metais resistem às forças que, quando aplicadas, tendem a alongar uma barra ou um fio metálico. esses metais são usados nos cabos de aço dos elevadores.
- maleabilidade: propriedade que os metais apresentam de se deixarem dobrar (moldar) para formar lâminas.
- ductibilidade: propriedade que os metais apresentam de poder formar fios.
Ligas metálicas
As ligas metálicas são misturas de metais com propriedades características. As propriedades das ligas diferem das propriedades dos elementos constituintes separadamente.
No Brasil, elas são muito importantes para diferentes indústrias, como a automobilística, naval, construção civil e eletrônica. Vejamos alguns tipos de ligas:
- Bronze: formado pelo cobre (Cu) + estanho (Sn). É encontrado nas medalhas das Olímpiadas por exemplo, mas também em estátuas e em algumas moedas.
- Latão: é a união entre cobre (Cu) + zinco (Zn). Em algumas ligas, o latão também pode ter a mistura de outros metais, como alumínio (Al) e ferro (Fe).
- Aço comum: é a união entre ferro (Fe) + carbono (C). É uma ligação metálica considerada muito resistente.
- Ouro 18 quilates: provavelmente a liga metálica mais famosa, composta por ouro (Au) + prata (Ag) / cobre (Cu) (75% de ouro e 25% dos outros elementos).
A medida de quilate utilizada no Ouro representa a pureza do metal. O ouro 24 quilates é aquele considerado puro, ou seja, 99,99% de ouro (é o teor máximo, pois é praticamente impossível alcançar 100% de ouro). Curiosamente, o ouro 24 quilates não é utilizado na fabricação de joias, por ser altamente maleável.
Resumo complementar: Ligações Iônicas e Ligações Covalentes
Exercícios
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(UECE/2019)
A nível de ilustração, os núcleos dos átomos são considerados ilhas mergulhadas em um mar de elétrons. Essa comparação nos leva a concluir que se trata de uma ligação química
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 2 de 10
2. Pergunta
(Mackenzie SP/2018)
Assinale (V) para verdadeiro e (F) para falso, para as afirmações abaixo.
( ) Os metais apresentam alta condutividade elétrica, mas baixa condutividade térmica.
( ) O bronze é uma liga formada por cobre e estanho.
( ) Compostos iônicos conduzem corrente elétrica em meio aquoso e quando fundidos.
( ) A ligação covalente ocorre entre metais e não metais. O KBr é um exemplo.
( ) O dióxido de carbono é uma molécula apolar, mas que possui ligações covalentes polares.A sequência correta de preenchimento dos parênteses, de cima para baixo é
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 3 de 10
3. Pergunta
(UCB DF/2018)
Um profissional da gastronomia utiliza vários utensílios e alimentos para a preparação de pratos em um restaurante. Há nesse ambiente materiais metálicos e plásticos, além dos condimentos e dos próprios alimentos a serem utilizados. Com base no entendimento de como os processos do cotidiano estão imersos em transformações químicas e são dependentes das propriedades físico-químicas dos materiais, assinale a alternativa correta.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 4 de 10
4. Pergunta
(UECE/2018)
Um estudante de química encontrou, na bancada do laboratório, um frasco sem rótulo contendo uma substância desconhecida inodora e incolor. Submeteu a amostra a alguns testes e descobriu que ela apresentava altas temperaturas de fusão e de ebulição, boa condutividade elétrica, grande maleabilidade e boa condutividade térmica. A partir das informações coletadas, ele pode concluir acertadamente que o tipo de ligação predominante na citada substância era
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 5 de 10
5. Pergunta
(Faculdade Santo Agostinho BA/2018)
O ouro 18 quilates é formado por ouro (75%), prata (13%) e cobre (12%). Essa composição garante dureza, resistência, durabilidade e brilho, características que permitem a utilização dessa composição para produção de peças de joalheria. Aplicado ao ouro, o quilate é uma medida de pureza do metal. Em relação ao material usado para confecção de uma peça de 16 g, é CORRETO afirmar:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 6 de 10
6. Pergunta
(UEFS BA/2017)
Desde a antiguidade, o homem utiliza metais para a fabricação de utensílios diversos. A partir do século XVIII, a metalurgia tornou-se uma ciência, em que os processos metalúrgicos passaram a ser estudados e explicados, alavancando a obtenção dos metais a partir de minérios. A metalurgia é uma sequência de processos que visa à obtenção de um elemento metálico a partir de seu minério. Quanto maior a tendência do metal para sofrer corrosão, maior é a dificuldade de obtê-lo a partir do minério.
Sobre a obtenção de metais na metalurgia, é correto afirmar:
I. O alumínio é um metal de fácil obtenção a partir de seu minério, a bauxita, pois esse, por possuir baixa tendência em oxidar, é facilmente reduzido de Al3+ para Al0, se comparado a outros metais menos nobres, como o ferro e o chumbo.
II. Metais, como o ferro e o zinco, para serem obtidos a partir de seus minérios, devem ser aquecidos na presença de uma substância que vai provocar a redução desses metais, como o monóxido de carbono, que é um agente redutor.
III. O alumínio possui inúmeras aplicações, mas, por ser um metal pouco nobre, é difícil de ser obtido e sua redução é realizada em um processo denominado eletrólise.
IV. A prata é um metal nobre, sua principal fonte é o minério argentita (Ag2S), sendo que o processo de obtenção da prata metálica é realizado pelo aquecimento desse minério, que reage com o oxigênio, provocando a oxidação da prata.A alternativa em que todas as afirmativas indicadas estão corretas é a
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 7 de 10
7. Pergunta
(IFRS/2017)
Em uma Olimpíada, os atletas buscam suas melhores marcas, simbolizadas pelas medalhas de ouro, prata e bronze. Sobre esses materiais são feitas as afirmações:
I. O ouro é um metal excelente condutor de calor e eletricidade, cujo símbolo é Au.
II. A prata é um metal mais reativo que o ouro, por isso não é tão nobre e seu símbolo é Pt.
III. O bronze é um metal de cor amarronzada, muito duro, cujo símbolo é Br.Assinale a alternativa que contém a(s) afirmação(ões) correta(s).
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 8 de 10
8. Pergunta
(UEG GO/2017)
Neste ano, cientistas da Universidade de Harvard anunciaram a produção de hidrogênio metálico, submetendo hidrogênio molecular a altas pressões.
Dentre as propriedades características de compostos metálicos, encontra-se a
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 9 de 10
9. Pergunta
(UCS RS/2016)
Pesquisadores do Instituto de Tecnologia de Massachusetts, nos Estados Unidos, e da Universidade da Columbia Britânica, no Canadá, descobriram que nanofios de nióbio podem ser usados para desenvolver supercapacitores muito eficientes. A tecnologia inovadora poderia ser a solução para as minúsculas baterias utilizadas em dispositivos vestíveis, como aparelhos que monitoram a saúde e o desempenho de atividades físicas, uma vez que os nanofios ocupam pouco espaço, ao mesmo tempo em que liberam correntes elétricas de alta potência. Outros armazenadores de energia, como baterias e células de combustível, não se mostram muito eficientes quando reduzidas a microespaços. Além dos chamados “wearable gadgets” (acessórios que podem ser incorporados ao corpo ou “vestidos”), os supercapacitores à base de nióbio poderiam ser úteis para microrrobôs autônomos e drones, que também demandam alta potência. Por enquanto, o material está sendo produzido apenas em laboratório. O próximo passo, já em andamento, é desenvolver uma versão mais prática e mais fácil de ser produzida.
Disponível em: http://info.abril.com.br/noticias/ciencia/2015/07/mit-1.shtml.
Acesso em: 20 ago. 15. (Adaptado.)Em relação ao nióbio, analise as proposições a seguir, quanto à sua veracidade (V) ou falsidade (F).
( ) O elemento químico nióbio é um metal de transição interna do quarto período da Tabela Periódica.
( ) Átomos de nióbio, no estado fundamental, apresentam 5 elétrons na camada de valência.
( ) O elétron de maior energia de um átomo de nióbio, no estado fundamental, encontra-se no subnível 4s.
( ) A liga ferro-nióbio é um exemplo de solução sólida, onde os átomos de ferro e de nióbio estão unidos entre si por meio de ligações metálicas.Assinale a alternativa que preenche correta e respectivamente os parênteses, de cima para baixo.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 10 de 10
10. Pergunta
(UFRGS RS/2016)
A grande utilização dos metais demonstra sua importância para a humanidade e decorre do fato de as substâncias metálicas apresentarem um conjunto de propriedades que lhes são características.
Considere as informações abaixo que justificam, de forma adequada, propriedades típicas dos metais, com base no modelo do mar de elétrons.I. Metais apresentam geralmente elevados pontos de fusão devido à grande estabilidade do retículo cristalino metálico.
II. A boa condução de calor ocorre pois o aquecimento aumenta a vibração dos íons positivos, possibilitando que eles capturem os elétrons livres, o que provoca a desestruturação do retículo cristalino metálico e possibilita a propagação do calor.
III. A boa condução de eletricidade é explicável, pois a aplicação de uma diferença de potencial provoca uma movimentação ordenada dos elétrons livres.Quais estão corretas?
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!

Sobre o(a) autor(a):
Roseli Prieto - Texto elaborado por Roseli Prieto, professora de Química e Biologia da rede estadual de São Paulo. Já atuou em diversas escolas públicas e privadas de Santos (SP). É Gestora Ambiental e Especialista em Planejamento e Gestora de cursos a distância.
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


