Reações de oxidação e número de oxidação
Você já deve estar preocupado com os termos oxidação e redução. Mas calma, você irá saber que estes processos ocorrem no nosso cotidiano e não são tão difíceis de entender e diferenciar. Então venha aumentar seus conhecimentos e se preparar melhor para o Enem estudando conosco!
O número de oxidação representa o número de elétrons que o átomo realmente perdeu ou ganhou durante uma reação química. Este número está relacionado com a eletronegatividade, ou seja, a tendência que o átomo do elemento possui de atrair elétrons quando ligado a outro átomo.
O número de oxidação varia conforme cada elemento químico e do composto por ele formado, assim, este número representa a carga elétrica que um átomo de um elemento adquire quando participa de uma reação.
Se a ligação for iônica, este número será sua carga, mas, se for uma ligação covalente (molecular), será o valor parcial que o elemento adquirirá durante a ligação covalente. Por isso, a maioria dos elementos químicos apresenta diversos números de oxidação, dependendo do composto que ele está formando.
Número de Oxidação (NOX)
Já o número de oxidação (NOX) tem relação com o balanço de cargas dentro de um composto. Parece complicado não? Mas para isso ocorrer temos algumas regras básicas que devem ser conhecidas para determinarmos o número de oxidação dos elementos:

Agora para realizar o cálculo do número de oxidação de cada elemento temos as seguintes regras:
- a) em uma substância simples, o elemento apresenta NOX igual a zero, pois não há diferença de eletronegatividade entre os átomos. Exemplo: H2; Cl2; Fe.
- b) em um íon simples, o NOX do elemento é a própria carga do íon. Exemplo: Na +1 ; Au +¹ ; Fe +³ ; N –³.
- c) em uma substância composta, a soma dos NOX de todos os elementos é igual a zero.
Exemplo: (observar os NOX na tabela acima).
H2SO4
O NOX do H é +1. Assim, como temos 2 H, iremos multiplicar (2×1 = 2)
O NOX do S aqui é desconhecido. Chamaremos de x.
O NOX do O é -2. Assim, como temos 4 O, iremos multiplicar (4x (-2) = -8)
Assim, como sabemos que a soma terá que ser zero, podemos somar: 2 + x – 8 = 0
Portanto, x = 6
Na4P2O7
O NOX do Na é +1. Assim, como temos 4 Na, iremos multiplicar (4×1 = 4)
O NOX do P aqui é desconhecido. Chamaremos de y.
O NOX do O como já vimos é -2. Multiplicando temos (7x (-2) = – 14)
Agora podemos somar:
4 + 2y – 14 = 0
2 y = 10
y = 5
- d) em um íon composto, a soma dos NOX de todos os elementos é igual à carga do íon. Exemplo:
NH41+
O NOX do N aqui é desconhecido. Chamaremos de x.
O NOX do H é +1. Assim, como temos 4 H, iremos multiplicar (4×1 = 4)
Note que a carga do íon NH4 é 1+, portanto a soma do NOX desse íon composto deverá ser 1+.
Somando: x + 4 = 1
x = – 4 + 1
x = – 3.
Cr2O72-
O NOX do Cr aqui é desconhecido. Chamaremos de y.
O NOX do O -2. Multiplicando temos (7x(-2) = – 14)
Note que a carga do íon Cr2O7 é 2-, portanto a soma do NOX desse íon composto deverá ser -2.
Somando: 2y – 14 = -2
2y = 12
y = 6.
Reações de Oxidação
Na reação de oxirredução ocorre transferência de elétrons de um composto para outro. O composto que perde elétrons sofre oxidação; e o que ganha elétrons sofre redução. Para identificar quem perdeu ou ganhou elétrons na reação, você precisa saber seu NOX.
Como identificar isso numa reação química?
A oxidação ocorre quando o átomo perde elétrons, estes, por sua vez, não desaparecem, eles serão absorvidos por outro composto que irá sofrer um processo de redução, ou seja, receber elétrons.
Sempre que ocorre uma redução também ocorre uma oxidação; assim, esses processos são as reações de oxirredução.
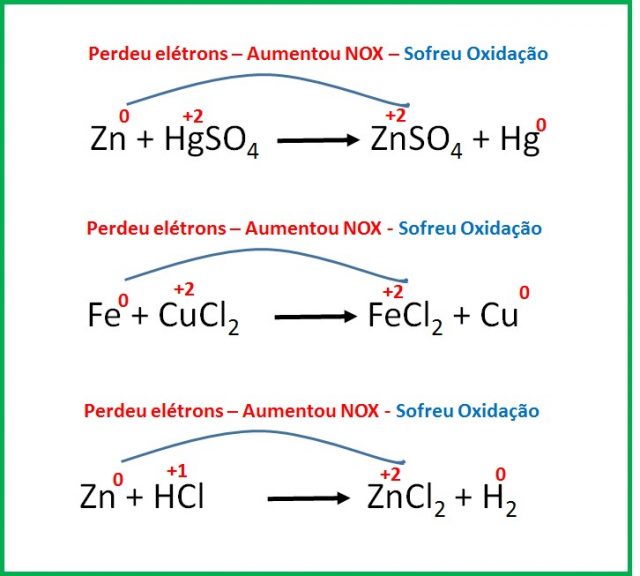
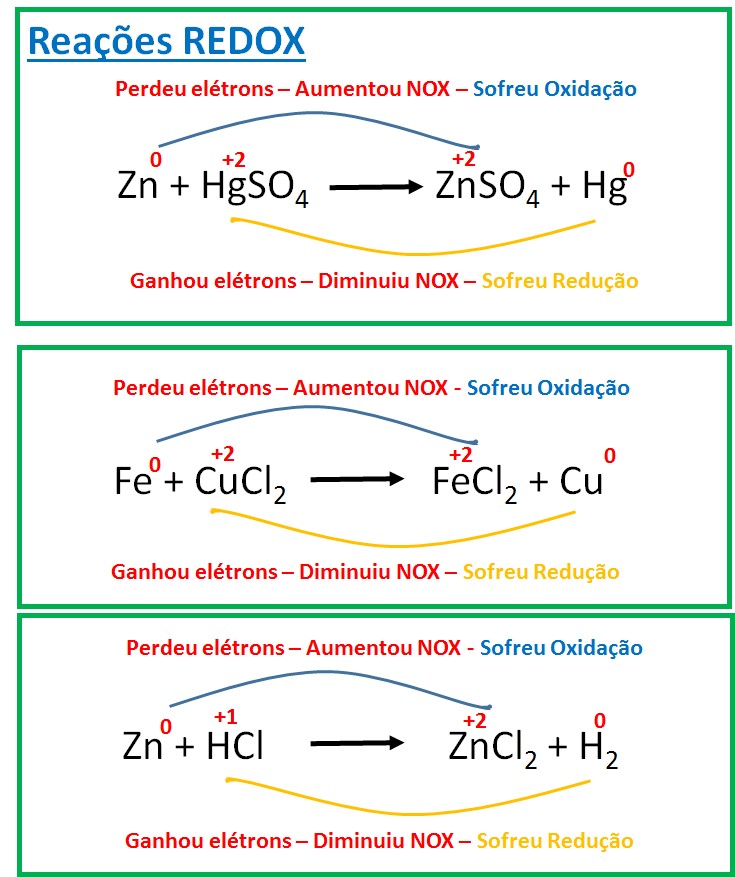
Quando uma substância oxida, é porque a outra substância retirou elétrons dela. A substância que contém o átomo que ganhou elétrons é o agente oxidante; e a substância que contém o átomo que forneceu os elétrons é o agente redutor.
Vamos fazer um resuminho:
Agente redutor:
sofre oxidação;
provoca redução;
perde elétrons;
NOX aumenta
Agente oxidante:
sofre redução;
provoca oxidação;
ganha elétrons;
NOX diminui
Tipos de reações de oxidação:
a) oxidação do ferro: representa a ferrugem. Todos os metais podem sofrer oxidação, devido ao contato dos metais com o ar e a água. Primeiro ocorre o desgaste do metal, que é o processo de corrosão, em virtude da oxidação, e depois forma-se a ferrugem.
2 Fe + O2 + 2 H2O → 2 Fe(OH)2
Além dos metais, a oxidação também ocorre com os hidrocarbonetos, principalmente com os alcenos, e pode ser: combustão, ozonólise, oxidação branda e oxidação energética. Nesta aula iremos estudar apenas combustão, sendo os outros conceitos abordados futuramente.
b) combustão: reação química de uma substância com o oxigênio, produzindo calor e luz. O oxigênio é chamado de comburente, pois alimenta a chama, e a substância com o carbono, é o combustível. Os combustíveis sofrem oxidação (perdem elétrons/NOX aumenta), e o comburente (oxigênio) sofre redução (ganha elétrons/NOX diminui) para formação dos produtos.
A combustão pode ser completa (quando há oxigênio suficiente para consumir todo o combustível, formando-se CO2 e H2O), e incompleta (quando não há oxigênio suficiente para consumir todo o combustível. formando-se CO e H2O).
Tá difícil entender número de oxidação e reações de redox? Então veja a parodia dos professores de Química com a música Shallow e duas aulas sobre o tema!
E videoaula também, claro xD
Agora teste seus conhecimentos com os exercícios abaixo:
1) (IFSul 2016) – A chuva ácida ocorre quando existe na atmosfera uma alta concentração de óxidos de enxofre (SO2) e óxidos de nitrogênio (NO, NO2, N2O5) que, quando em contato com a água em forma de vapor, formam ácidos como o HNO3 e H2SO4. Os Nox do nitrogênio e do enxofre, nestes ácidos, são respectivamente
a) +5 e +6.
b) +5 e +4.
c) +3 e +6.
d) +6 e +4.
gab.: a
2) (UFSCAR-SP) – Os números de oxidação do enxofre em H2S, S8 e Na2SO3 são, respectivamente,
a) +2, -8 e -4.
b) -2, zero, e +4.
c) zero, -4 e +3.
d) +1, -2 e -3.
e) -6, +8 e -5.
gab.: b
3) (UFRGS RS/2017)
Nos compostos H2SO4, KH, H2, H2O2, NaHCO3, o número de oxidação do elemento hidrogênio é, respectivamente,
a) +1, –1, 0, +1, +1.
b) +1, +1, +1, 0, +1.
c) +1, –1, 0, +2, +1.
d) –1, –1, +1, +1, –1.
e) –1, +1, 0, +1, +2.
gab.: a
4) (FAMERP SP/2016)
A imagem mostra o resultado de um experimento conhecido como “árvore de prata”, em que fios de cobre retorcidos em formato de árvore são imersos em uma solução aquosa de nitrato de prata.

Nesse experimento, ocorre uma reação de oxirredução, na qual
a) átomos de cobre se reduzem.
b) íons de cobre se reduzem.
c) íons nitrato se oxidam.
d) íons de prata se reduzem.
e) átomos de prata se oxidam.
gab.: D
5) (UEFS BA/2018)
Quando um prego de ferro é mergulhado em uma solução aquosa de sulfato de cobre(II), observa-se a formação de cobre metálico sobre a superfície do prego em decorrência da reação representada por
Fe (s) + CuSO4 (aq) Cu (s) + FeSO4 (aq)
Essa é uma reação de oxirredução na qual
a) o ferro metálico perde elétrons e, portanto, é o agente oxidante.
b) o ferro metálico perde elétrons e, portanto, é o agente redutor.
c) o ferro metálico ganha elétrons e, portanto, é o agente oxidante.
d) o íon de cobre(II) ganha elétrons e, portanto, é o agente redutor.
e) o íon de cobre(II) perde elétrons e, portanto, é o agente oxidante.
Gab.: b





