Como calcular o rendimento de uma reação química
Saiba como calcular o rendimento de uma reação química. Se liga nesta revisão do Curso Enem Gratuito para você gabaritar as questões envolvendo Química no Enem!
No processo atual da obtenção do etanol, apenas um terço da cana, o caldo, é aproveitado para a produção de açúcar em etanol. O restante constitui-se de bagaço e de palha descartada na colheita. O grande desafio é aproveitar a celulose presente no bagaço e na palha da cana para aumentar o rendimento de produção do etanol. O aumento do rendimento dos processos é uma preocupação da indústria química de maneira geral. Por isso, é importante estudar o rendimento de uma reação química!
O rendimento de uma reação química
O rendimento de uma reação química é a relação entre a quantidade realmente obtida de produto e a quantidade teoricamente calculada. Quando pensamos em uma reação química para a produção de determinado produto, pensamos em quanto de matéria prima iremos utilizar e estimamos o quanto ela irá produzir. Ou seja, interessa o quanto essa reação química irá render de produto final.
Fatores que interferem no rendimento da reação
Para infelicidade da indústria, os processos químicos costumam apresentar um rendimento menor do que o teoricamente esperado pelos cálculos estequiométricos. Isso acontece porque diversos fatores podem influenciar no resultado de uma reação química. Veja alguns dos fatores que interferem no rendimento de uma reação química:
- Podem ocorrer reações paralelas à que desejamos e, com isso, uma parte de um ou de ambos os reagentes é consumida, formando produtos indesejáveis;
- A reação pode ficar incompleta por ser reversível. Assim, parte do produto formado é novamente convertida em reagentes;
- Podem ocorrer perdas de produto durante a reação, como ao serem usadas aparelhagens de má qualidade ou por algum erro do operador.
Como calcular o rendimento de uma reação química
O cálculo para obter o rendimento de uma reação química, expresso em porcentagem, pode ser feito dividindo-se a quantidade de produto real pela quantidade de produto teórico e, ao final, multiplicando o resultado dessa divisão por cem. Ou seja, a fórmula do rendimento da reação química é:
Rendimento = (qtd de produto real / qtd de produto teórico) x 100
Exercício resolvido
Vamos ver um exemplo para ficar mais claro?
Uma amostra de calcário e de outros componentes do solo foi intensamente aquecida. Nessas condições, o calcário sofre decomposição em óxido de cálcio e dióxido de carbono.
![]()
A análise de 35,71g de uma amostra de calcário forneceu 13,0 g de óxido de cálcio, além de dióxido de carbono, após o aquecimento a alta temperatura. Determine o rendimento percentual da transformação.
Dados: C = 12 g/mol; Ca = 40 g/mol; O = 16 g/mol
Primeiramente vamos calcular a massa de óxido de cálcio que seria obtida por meio do rendimento teórico (100%):
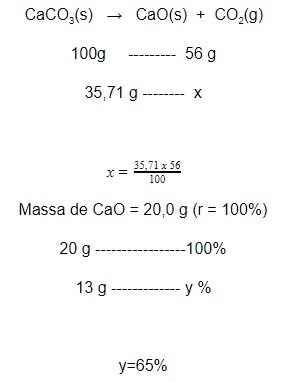
Portanto, o rendimento é de 65%.
O exemplo mostrado acima considerou o caso com rendimento de 100%, chamado de rendimento teórico. Agora vamos ver um exemplo com rendimento real, chamado rendimento da reação, que corresponde a uma porcentagem do valor teoricamente esperado.
O sulfato de cálcio ![]() é a matéria prima do giz e pode ser obtido pela reação entre soluções aquosas de cloreto de cálcio e de sulfato de sódio (conforme a reação abaixo). Sabendo disso, calcule a massa de sulfato de cálcio obtida pela reação de 2 mol de cloreto de cálcio com excesso de sulfato de sódio, considerando-se que o rendimento da reação é igual a 75%.
é a matéria prima do giz e pode ser obtido pela reação entre soluções aquosas de cloreto de cálcio e de sulfato de sódio (conforme a reação abaixo). Sabendo disso, calcule a massa de sulfato de cálcio obtida pela reação de 2 mol de cloreto de cálcio com excesso de sulfato de sódio, considerando-se que o rendimento da reação é igual a 75%.
Dado: Massa molar do ![]() = 136 g/mol
= 136 g/mol
![]()
Cálculo da massa de sulfato de cálcio que seria obtida por meio de rendimento de 100%:
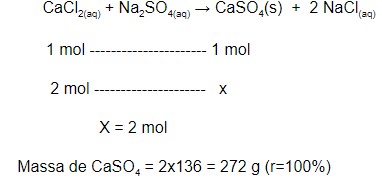
Videoaula
Agora, para reforçar mais sua revisão sobre rendimento das reações químicas, assista à videoaula da professora Larissa no nosso canal:
Exercícios
Para finalizar sua revisão, resolva os exercícios sobre rendimento das reações químicas que selecionamos para você!
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(Fac. de Ciências da Saúde de Barretos SP/2014)
A anilina (C6H5NH2), matéria-prima importante para diversos ramos das indústrias química e farmacêutica, pode ser obtida pela reação entre nitrobenzeno e ferro, representada pela seguinte equação:
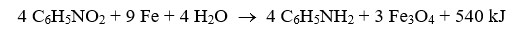
Supondo um rendimento de 100%, é correto afirmar que a massa, em kg, de anilina obtida pela reação completa de 246 kg de nitrobenzeno é igual a
CorretoParabéns! Siga para a próxima questão.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre rendimento de reações químicas para acertar na hora da prova!
-
Pergunta 2 de 10
2. Pergunta
(UEA AM/2014)
Considere o acetileno, C2H2, um gás extremamente inflamável, empregado em maçaricos oxi-acetileno, que os funileiros utilizam para corte e solda de metais. Esse gás pode ser obtido pela reação de carbeto de cálcio com água, de acordo com a equação:
CaC2 (s) + 2 H2O (l) → C2H2 (g) + Ca(OH)2 (s)
Considerando que a reação tenha um rendimento de 80%, a massa de acetileno formada pela transformação de 12,8 kg de carbeto de cálcio é, em kg, igual a
CorretoParabéns! Siga para a próxima questão.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre rendimento de reações químicas para acertar na hora da prova!
-
Pergunta 3 de 10
3. Pergunta
(UFPA/2013)
Substâncias químicas de interesse industrial podem ser obtidas por meio de extração de plantas, produzidas por micro-organismos, sintetizadas em laboratórios, entre outros processos de obtenção. Abaixo é apresentado um esquema de reação para obtenção de uma substância utilizada como flavorizante na indústria de alimentos.
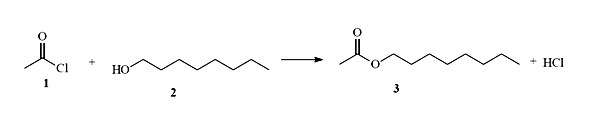
Admitindo-se que todos os reagentes são puros e que o rendimento da reação seja de 90%, a quantidade (em kg) da substância 3, obtida a partir da reação de 8,0 kg da substância 2, é de aproximadamente
Dados: massas molares (g/mol): H = 1,0; C = 12,0; O = 16,0
CorretoParabéns! Siga para a próxima questão.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre rendimento de reações químicas para acertar na hora da prova!
-
Pergunta 4 de 10
4. Pergunta
(UNIFICADO RJ/2011)
No equilíbrio químico, o deslocamento provoca um aumento do rendimento da reação e tem grande importância, principalmente para a indústria, pois, quanto maior a produção em curto tempo com a diminuição dos custos, melhor será o processo. Os fatores externos que podem deslocar o equilíbrio químico são: concentração, pressão e temperatura. Seja uma mistura de N2, H2 e NH3 em equilíbrio (síntese da amônia). Nesse momento, as concentrações do N2 e H2 são:
[N2] = 1,0 x 10–12 mol.L–1 e [H2] = 2,0 x 10–8 mol.L–1
Considere o valor da constante de equilíbrio a 298 K como 6,125 x 104. O valor da concentração da amônia, nessas condições, em mol/L, é
CorretoParabéns! Siga para a próxima questão.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre rendimento de reações químicas para acertar na hora da prova!
-
Pergunta 5 de 10
5. Pergunta
(UFRN/2009)
Uma das principais descobertas que impulsionou a produção de alimentos foi o processo industrial de Haber-Bosch da produção de amônia, que ocorreu há cerca de 100 anos, de acordo com a reação (1):
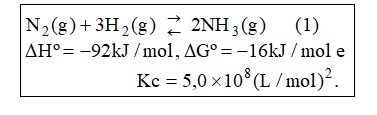
Considerando-se um rendimento de 50% para a reação (1) e sabendo-se que, nas CNTP, 1,00 mol de gás ocupa 22,4 L, o volume de NH3produzido a partir de 28 kg de N2é:
CorretoParabéns! Siga para a próxima questão.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre rendimento de reações químicas para acertar na hora da prova!
-
Pergunta 6 de 10
6. Pergunta
(FEEVALE RS/2001)
A decomposição térmica do calcário (CaCO3 → CaO + CO2) é uma reação usada há muito tempo. Tal decomposição permite obter a cal, utilizada em argamassa, uma espécie de cola para pedras e/ou tijolos. A Grande Muralha da China, na foto, foi construída com argamassa de cal.

Suponha que uma indústria possua 8000 kg de calcário com 95% de pureza em CaCO3 e quer obter cal virgem (CaO) por decomposição térmica desse calcário. Que massa de cal virgem obterá se o processo apresentar um rendimento de 95 % ?
CaCO3 → CaO + CO2
CorretoParabéns! Siga para a próxima questão.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre rendimento de reações químicas para acertar na hora da prova!
-
Pergunta 7 de 10
7. Pergunta
(UFF RJ/1996)
O etanol (C2H5OH) pode ser produzido por fermentação da glicose (C6H12O6), conforme a reação:
C6H12O6 fermentação → 2C2H5OH + 2CO2
Se 360 g de glicose produzem 92 g de etanol, o rendimento deste processo é:
CorretoParabéns! Siga para a próxima questão.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre rendimento de reações químicas para acertar na hora da prova!
-
Pergunta 8 de 10
8. Pergunta
(UNITAU SP/2018)
A cromação é a aplicação do metal de transição cromo sobre um material, geralmente metálico, por meio de eletrodeposição (processo eletrolítico de revestimento de superfícies com metais), a fim de torná-lo mais resistente à corrosão. O cromo é produzido a partir da seguinte reação:
Cr2O3(s) + 2 Al(s) → 2 Cr(s) + Al2O3(s)
Considere que a superfície metálica de uma motocicleta necessita de 125 gramas de cromo para a cromação. Assinale a alternativa que apresenta o valor CORRETO de massa de Cr2O3(s) necessária para essa cromação, admitindo-se que a reação acima tenha um rendimento de 75%.
CorretoParabéns! Siga para a próxima questão.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre rendimento de reações químicas para acertar na hora da prova!
-
Pergunta 9 de 10
9. Pergunta
(Fac. Direito de São Bernardo do Campo SP/2017)
A síntese da amônia (NH3) a partir dos gases nitrogênio (N2) e hidrogênio (H2) é uma reação de grande importância para a indústria de fertilizantes e explosivos. O processo adotado ainda hoje foi desenvolvido pelos alemães Haber e Bosch no início do século XX, diminuindo a dependência da Alemanha do salitre (KNO3) importado principalmente do Chile.
A reação pode ser representada pelo equilíbrio
O rendimento de formação de amônia em função da temperatura e da pressão está representado no gráfico a seguir.
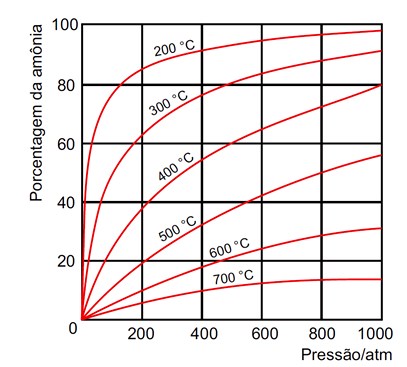
Industrialmente, a amônia é obtida sob pressão de 100 a 250 atm e temperatura entre 400 e 500 ºC.
Sobre a síntese da amônia foram feitas as seguintes afirmações:
I. Trata-se de um processo exotérmico.
II. Em uma mesma temperatura, o aumento da pressão aumenta a constante de equilíbrio de formação da amônia.
III. Nas condições adotadas pela indústria, a porcentagem de amônia presente na mistura em equilíbrio é de aproximadamente 60 %.
IV. Em temperaturas baixas, a reação é muito lenta devido à alta energia de ativação do processo, tornando a condição desvantajosa financeiramente.Estão corretas apenas as afirmações:
CorretoParabéns! Siga para a próxima questão.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre rendimento de reações químicas para acertar na hora da prova!
-
Pergunta 10 de 10
10. Pergunta
(ENEM/2017)
O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol), é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:
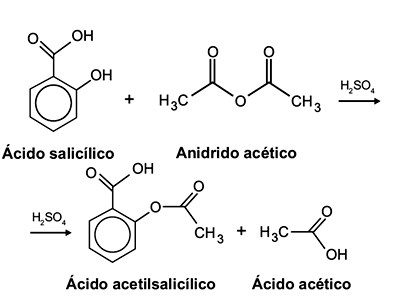
Após a síntese, o AAS é purificado e o rendimento final é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
CorretoParabéns! Siga para a próxima questão.
IncorretoResposta incorreta. Revise o conteúdo nesta aula sobre rendimento de reações químicas para acertar na hora da prova!

Sobre o(a) autor(a):
Munique Dias - Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia Química, também pela UFSC.
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


