Hipótese de Avogadro – Simulado de Química
Estude Química para o Enem com o Simulado de Avogadro. São 10 questões gratuitas com gabarito na hora. E se errar, tem aula para revisar o conteúdo!
Mol é uma palavra um tanto assustadora para muitos estudantes, mas garantimos que não precisa ter medo. A aula em vídeo do professor Sobis vai lhe ajudar a entender o conceito de uma vez por todas:
E só para garantir seu aprendizado, aproveite para se aprofundar no tema com mais um conteúdo em vídeo, que você confere abaixo:
Boa! Agora você está mais do que afiado para encarar o simulado e testar seus conhecimentos. Boa prova!
Hipótese de Avogadro – Simulado de Química
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(UECE/2016)
Em alguns casos, há necessidade de coletar-se o produto de uma reação sob a água para evitar que ele escape e misture-se com o ar atmosférico. Uma amostra de 500 mL de oxigênio foi coletada sob a água a 23 ºC e pressão de 1 atm. Sabendo-se que a pressão de vapor da água a 23 ºC é 0,028 atm, o volume que o O2 seco ocupará naquelas condições de temperatura e pressão será
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 2 de 10
2. Pergunta
(UNIFOR CE/2015)
A Tabela abaixo apresenta informações sobre cinco gases contidos em recipientes separados e selados
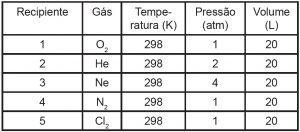
O recipiente que contém o maior número de moléculas é de número
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 3 de 10
3. Pergunta
(Unievangélica GO/2014)
Segundo Avogadro, “Gases quaisquer, ocupando o mesmo volume, nas mesmas condições de temperatura e pressão, contêm o mesmo número de moléculas”.
Considere os seguintes sistemas fechados contendo gases, todos com a mesma temperatura e pressão:
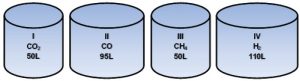
Há maior número de átomos de oxigênio e hidrogênio, respectivamente, nos sistemas
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 4 de 10
4. Pergunta
(ACAFE SC/2013)
Os gases ideais podem ser estudados pela equação P.V = n.R.T. Porém, nos gases reais usa-se a equação abaixo, de Van de Waals, onde P: pressão, n: número de moles, V: volume, R: 0,082 atm.L.mol–1.K–1, T: temperatura, a e b são constantes empíricas que variam para cada tipo de gás.

Dado: para resolução dessa questão considere a: 1,21 atm.L2.mol–2 e b: 0,10 L.mol–1.
Utilizando-se da equação de Van de Waals, qual a pressão exercida em um recipiente hermético de 2L por 1 mol de um gás real sob uma temperatura de 27ºC?
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 5 de 10
5. Pergunta
(Mackenzie SP/2013)
Considerando dois gases com comportamento ideal, CH4 e C2H6, contidos em compartimentos separados e fechados, ambos com volumes iguais a 10 L, sob mesmas condições de temperatura e pressão, de acordo com a hipótese de Avogadro, pode-se afirmar que ambos os gases
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 6 de 10
6. Pergunta
(UESPI/2010)
Na química alguns conceitos são de grande importância para a compreensão de certos fenômenos.
Relacione os conceitos citados abaixo com os seus respectivos significados.
1) Transformação Química
2) Substância Pura
3) Alótropos
4) Hipótese de Avogadro( ) Apresenta, em uma curva de aquecimento, temperatura de ebulição e de fusão constantes.
( ) Muda a natureza íntima da matéria.
( ) Volumes iguais de gases, nas mesmas condições de temperatura e pressão, têm o mesmo número de moléculas.
( ) São formas alternativas de um elemento que diferem na maneira como os átomos estão ligados.A sequência correta é:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 7 de 10
7. Pergunta
(UFLA MG/2009)
Segundo Avogadro, volumes iguais de gases quaisquer, na mesma pressão e temperatura, contêm igual número de moléculas.
Considerando a seguinte reação:
4NH3 (g) + 5O2 (g) → 4NO (g) + 6H2O (g)
Assinale a alternativa que indica CORRETAMENTE o volume (em mL) de NH3, NO e H2O, respectivamente, sabendo‐se que o volume de O2 consumido foi de 100 mL.CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 8 de 10
8. Pergunta
(UNIFOR CE/2014)
O metano, CH4, é formado nos aterros sanitários pela ação de certas bactérias em matéria orgânica queimada.
Uma amostra de metano, coletada em um aterro, tem volume de 250 mL a 750 Torr e 27 ºC. (R = 0,0821 L. atm. K–1. mol–1)
A quantidade de metano presente na amostra é:CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 9 de 10
9. Pergunta
(UFTM MG/2013)
Em uma indústria que comercializa gases industriais, um engenheiro elaborou uma lista com os cinco pedidos de compra recebidos num determinado dia de trabalho.
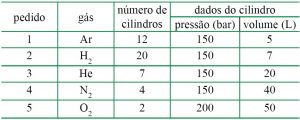
Sabendo que os cilindros rígidos e fechados estão armazenados na mesma condição de temperatura, o pedido que tem maior quantidade de matéria, em mol de gás, é o de número
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 10 de 10
10. Pergunta
(UNESP SP/2012)
Os desodorantes do tipo aerossol contêm em sua formulação solventes e propelentes inflamáveis. Por essa razão, as embalagens utilizadas para a comercialização do produto fornecem no rótulo algumas instruções, tais como:
– Não expor a embalagem ao sol.
– Não usar próximo a chamas.
– Não descartar em incinerador.Uma lata desse tipo de desodorante foi lançada em um incinerador a 25 °C e 1 atm. Quando a temperatura do sistema atingiu 621 °C, a lata explodiu. Considere que não houve deformação durante o aquecimento. No momento da explosão a pressão no interior da lata era
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
Sobre o(a) autor(a):
Ana Carolina Prieto -
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


