Saiba o que são substâncias puras e conheça os tipos de misturas. Estude com o Curso Enem Gratuito e arrebente em Química no Exame Nacional do Ensino Médio!
Para o estudo de substâncias e misturas é necessário compreender que a natureza apresenta uma grande diversidade de materiais. É preciso também analisar a composição e as propriedades desses materiais para que eles possam ser utilizados.
Para facilitar essa análise os cientistas delimitaram uma porção do universo que será o foco da análise e recebe o nome de sistema.
Fases, sistemas homogêneo e heterogêneo
Você já observou uma porção de água filtrada? Consegue perceber aspectos diferentes em todos os seus pontos? Não né?
Por isso a água filtrada corresponde a um sistema homogêneo, diferentemente da madeira, que não apresenta um aspecto uniforme em sua extensão, correspondendo a sistema heterogêneo. Cada um dos diferentes aspectos observados em um sistema é chamado de fase.
Vamos aos conceitos?
- Fase: É uma porção do sistema que apresenta as mesmas características em todos os seus pontos, sendo, portanto, de aspecto uniforme mesmo observada ao microscópio comum.
- Sistema homogêneo: apresenta aspecto uniforme e as mesmas características em toda sua extensão. Esse sistema é monofásico (constituído por uma única fase).
- Sistema heterogêneo: Apresenta diferentes aspectos e diferentes características em sua extensão. Esse sistema é formado por duas fases (bifásico), por três (trifásico) ou mais (polifásico).
Não se engane!
A observação de um sistema homogêneo ou heterogêneo a olho nu nem sempre é confiável! O leite, por exemplo, tem uma aparência homogênea a olho nu, mas microscopicamente apresenta pequenas porções de gordura dispersas no líquido, portanto se trata de um sistema heterogêneo.
Substância pura e mistura
Você sabe como diferenciar uma substância pura de uma mistura?

Para identificar uma substância pura ou simples, podemos observar suas propriedades específicas, que são particulares e exclusivas de cada material, como por exemplo, ponto de fusão, ponto de ebulição e densidade.
Por exemplo, o cloreto de sódio, principal constituinte do sal de cozinha, apresenta sempre características próprias: é formado por pequenos cristais brancos, tem sabor característico (salgado) e apresenta densidade, temperaturas de fusão e ebulição e outras propriedades constantes.

Quando uma substância é adicionada a outra, elas deixam de ser puras e passam a ser mistura. Suas propriedades variam conforme a proporção de cada componente. O soro fisiológico, por exemplo, é uma mistura que contém 0,9 g de cloreto de sódio em 100 mL de água.
Misturas homogêneas e heterogêneas
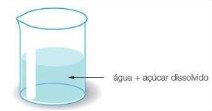
De acordo com o aspecto, as misturas podem ser classificadas em homogêneas e heterogêneas.
Água com açúcar diluído, álcool comercial, ar isento de partículas sólidas, sabe o que essas misturas têm em comum? Elas apresentam o mesmo aspecto em todos os pontos, ainda que observadas por microscópios potentes. Todos esses exemplos formam misturas homogêneas, portanto:
Em uma mistura homogênea ou solução, as unidades constituintes de um componente distribuem-se entre as do(s) outro(s), sem que seja possível distingui-los.
Não esqueça!

As misturas gasosas são sempre homogêneas! Mesmo que um dos gases seja colorido, depois de algum tempo as substâncias gasosas se misturam uniformemente, formando uma mistura homogênea.
As misturas heterogêneas apresentam regiões com vários aspectos, as chamadas fases que podem ser diferenciadas a olho nu.
Mas como você pode diferenciar uma mistura homogênea de uma substância pura?
Através da curva de aquecimento, um gráfico que mostra a variação de temperatura de uma amostra quando aquecida ou resfriada. Podemos observar que nas mudanças de estado físico a temperatura permanece constante e que, durante o aquecimento sem mudança de estado, sua variação é linear, caracterizando assim, uma substância pura.
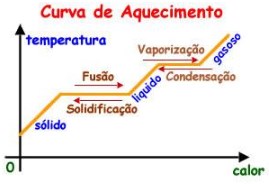
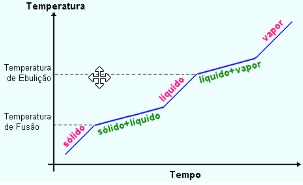
Já para as misturas homogêneas o patamar para a mudança de estado, ponto de fusão (PF) e ponto de ebulição (PE) não é constante:
Videoaula
Saiba mais sobre substâncias e misturas assistindo à videoaula do nosso canal com o prof. Sobis:
Exercícios
1. (UEL-PR) Sobre substâncias simples, são formuladas as seguintes proposições:
I) são formadas por um único elemento químico;
II) suas fórmulas são representadas por dois símbolos químicos;
III) podem ocorrer na forma de variedades alotrópicas;
IV) não podem formar misturas com substâncias compostas.
São incorretas:
a) I e II
b) I e III
c) II e III
d) II e IV
e) III e IV
2. (MACKENZIE-SP) À temperatura ambiente, uma substância simples sólida, uma substância composta gasosa e uma solução podem ser representadas, respectivamente, por:
a) Fe, NaCℓ e CO
b) H2, NH3 e NaCℓ
c) O2, CO2 e C grafite
d) Hg, KI e H2SO4 (diluido)
e) Au, CO2 e água mineral
Gabarito:
1.d, 2.e
Simulado
Para finalizar a aula, resolva o seguinte simulado:
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(UERJ/2019)
Novas tecnologias de embalagens visam a aumentar o prazo de validade dos alimentos, reduzindo sua deterioração e mantendo a qualidade do produto comercializado. Essas embalagens podem ser classificadas em Embalagens de Atmosfera Modificada Tradicionais (MAP) e Embalagens de Atmosfera Modificada em Equilíbrio (EMAP). As MAP são embalagens fechadas que podem utilizar em seu interior tanto gases como He, Ne, Ar e Kr, quanto composições de CO2 e O2 em proporções adequadas. As EMAP também podem utilizar uma atmosfera modificada formada por CO2 e O2 e apresentam microperfurações na sua superfície, conforme ilustrado abaixo.

Adaptado de exclusive.multibriefs.com.
Dentre os gases citados no texto, aquele que corresponde a uma substância composta é simbolizado por :
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 2 de 10
2. Pergunta
(UCB DF/2017)
A água é uma substância essencial à vida, mas também essencial no cotidiano da atividade industrial e comercial da sociedade, porque o respectivo uso vai além do consumo humano, e abarca a utilização em áreas como o saneamento e a produção de diversos produtos industriais. Acerca desse bem universal, assinale a alternativa correta.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 3 de 10
3. Pergunta
(UCB DF/2016)
Acerca da definição e classificação dos materiais e das substâncias químicas, assinale a alternativa correta.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 4 de 10
4. Pergunta
(PUC RS/2015)
Analise as informações a seguir.
Durante séculos, filósofos e alquimistas acreditaram que a matéria era constituída de quatro elementos fundamentais: terra, água, ar e fogo. Hoje, contudo, reconhecemos a existência de muito mais do que quatro elementos e alcançamos uma compreensão mais apro¬fundada sobre o que, de fato, são água, ar, terra e fogo.
Sobre esse assunto, são feitas as seguintes afirmativas:
I. A água é uma substância simples.
II. O ar é uma solução.
III. A terra é uma mistura heterogênea.
IV. O fogo é uma reação redox endotérmica.São corretas somente as afirmativas
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 5 de 10
5. Pergunta
(IFRS/2014)
A água potável é definida como
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 6 de 10
6. Pergunta
(PUC RS/2014)
Analise as informações e as afirmativas a seguir.
Em nossa sociedade, o carvão mineral é uma importante fonte energética. A existência de grandes jazidas e a facilidade de exploração fazem com que seu uso por usinas termelétricas, como por exemplo a de Candiota, tenha baixo custo econômico. Contudo, há desvantagens no uso do carvão mineral: o principal componente do carvão, no momento da queima, produz dióxido de carbono gasoso, conhecido por provocar o aquecimento global. Além disso, o carvão mineral de muitas regiões possui elevado teor de cinzas, o que diminui seu rendimento como fonte de energia; esse é o caso do carvão encontrado no Rio Grande do Sul. Como se não bastassem essas desvantagens, o carvão mineral muitas vezes encontra-se misturado com um mineral chamado pirita, que é um sulfeto de ferro, popularmente conhecido como ouro-de-tolo. No momento da queima do carvão, a pirita que estiver presente é oxidada com produção de dióxido de enxofre, poluente gerador de chuva ácida e altamente nocivo à vegetação.
Sobre esse assunto, são feitas as seguintes afirmações:
I. O principal componente do carvão é o mesmo elemento que compõe o grafite e o diamante.
II. O ouro-de-tolo é um composto iônico, podendo ser sintetizado pela reação direta entre ácido sulfúrico e um hidróxido de ferro.
III. A reação de combustão do carvão é classificada como exotérmica, pois ocorre com liberação de calor.
IV. O carvão pode contribuir para a formação de chuva ácida, que é a acidificação do solo e de lagos pela elevação do pH.Estão corretas apenas as afirmações
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 7 de 10
7. Pergunta
(UFV MG/2014)
Leia a notícia abaixo:
“Polícia dispersa manifestantes no gramado do Congresso
27 de junho de 2013│0h 05
AE – Agência Estado.…a polícia dispersou os milhares de manifestantes, no gramado do Congresso Nacional em Brasília, com diversas bombas de gás lacrimogêneo e efeito moral atiradas para o alto e caindo no meio da multidão.”
(Disponível em: http://www.estadao.com.br/noticias/geral,policia-dispersa-
manifestantes-no-gramado-do-congresso, 1047387,0.htm. Acesso em 04 jul. 2013.)A palavra “Lacrimogêneo” vem do Latim “lacrima” que significa lágrima. Além de lágrimas, o gás ainda pode causar: tosse, irritação na pele e vômitos. Os gases lacrimogêneos são classificados como agentes irritantes não-letais pela Convenção de Armas Químicas, um acordo firmado por 178 países. Como seus efeitos são temporários, a Convenção admite seu uso por forças policiais para dispersar multidões, mas proíbe seu uso como arma de guerra.
Este gás orgânico pertence à classe dos Haletos, que são compostos que apresentam pelo menos um átomo de um dos elementos químicos denominados Halogênios (coluna 17 da Tabela Periódica), além de átomos dos elementos carbono e hidrogênio.Com base nas informações acima e nos conhecimentos sobre o assunto, assinale a alternativa CORRETA:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 8 de 10
8. Pergunta
(FAMECA SP/2012)
Uma liga de solda utilizada em circuitos eletrônicos contém 63% de Sn e 37% de Pb (porcentagens em massa). Essa liga é uma mistura eutética, ou seja , uma mistura
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 9 de 10
9. Pergunta
(UECE/2011)
Em 1936, o pesquisador alemão Gerhard Schrader, ao tentar produzir um inseticida, descobriu, acidentalmente, o gás letal neurotóxico sarin, material utilizado em guerra química, cuja fórmula é C5H11N2O2P. O sarin, quando em contato com a pele ou inalado, gera contrações musculares, convulsões, estado de coma e paralisia do sistema respiratório, provocando a morte lenta da pessoa.
Sobre alguns dos elementos que constituem o sarin e que formam também substâncias essenciais à manutenção da vida, assinale a afirmação FALSA.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 10 de 10
10. Pergunta
(UESPI/2004)
O elemento químico fósforo pode ser encontrado na forma de duas substâncias simples: o fósforo branco, que é usado na produção de bombas de fumaça e cuja inalação provoca necrose dos ossos; e o fósforo vermelho, que é utilizado na fabricação de fósforo de segurança e se encontra na tarja da caixa e, não, no palito. Sobre o fósforo, assinale a alternativa correta.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
Sobre o(a) autor(a):
Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia Química, também pela UFSC.

