Como fazer o balanceamento das equações químicas
Vem com a gente aprender o balanceamento das equações químicas através do método das tentativas! É Química para mandar bem nas questões de Ciências da Natureza do Enem e dos vestibulares!
O balanceamento de uma equação química normalmente é objeto de muitas dúvidas e até medo por parte dos estudantes. Contudo, a partir do momento em que se entende o que é o balanceamento e o método para fazê-lo, é fácil perceber que não se trata de um bicho de sete cabeças.
Nesta aula você vai entender o que é o balanceamento das equações químicas, para que ele serve e como resolver questões com o método da tentativa.
O que é o balanceamento das equações químicas
As equações químicas estão corretas quando representam um fenômeno químico que realmente ocorre, por meio de fórmulas corretas (aspecto qualitativo) e coeficientes corretos (aspecto quantitativo). Lembrando que em uma reação química os átomos permanecem praticamente “intactos”.
Assim, podemos dizer que acertar os coeficientes ou balancear uma equação química é igualar o número total de átomos de cada elemento no 1º e no 2º membros da equação.
Observe a reação abaixo:
C2H6O(l) + O2(g) → CO2(g) + H2O(g)
As substâncias do lado esquerdo da seta (C2H6O e O2) ![]() são os reagentes. Enquanto isso, as substâncias do lado direito da seta CO2 e H2O são os produtos.
são os reagentes. Enquanto isso, as substâncias do lado direito da seta CO2 e H2O são os produtos.
Observe, na combustão do etanol que o número de átomos de carbono, por exemplo, não é o mesmo nos reagentes e nos produtos e essa desigualdade contraria a lei da conservação das massas.
Introdução ao Balanceamento Químico
Confira com o professor de química Felipe Sobis, do canal do Curso Enem Gratuito, quais os fundamentos que você precisa dominar para gabaritar geral em Balanceamento Químico:
Lei da conservação das massas
“Na natureza nada se cria, nada se perde, tudo se transforma” (Lavoisier). A lei da conservação de massas indica que a soma das massas de todos os reagentes deve ser igual à soma das massas de todos os produtos (princípio de Lavoisier).
Como fazer o balanceamento de equações químicas
Existem vários métodos utilizados para realizar o balanceamento de uma equação, mas o mais utilizado é o método das tentativas, que é baseado nos seguintes princípios:
- Atribuir um coeficiente inicial ao elemento (ou radical) que aparece apenas uma vez em um dos membros da reação;
- Se mais de um elemento aparece uma única vez, prefira o elemento que possui maior número de átomos (maiores índices);
- Escolhido o elemento, transponha seus índices de um membro para outro, usando-os como coeficientes;
- Prossiga com os outros elementos (ou radicais) usando o mesmo raciocínio até o fim do balanceamento.
Resumo sobre as Leis de Lavoisier e Proust
Aprenda os fundamentos do Postulado de Lavoisier. A frase virou um clássico universal: Na natureza nada se perde, nada se cria: tudo se transforma. E, complemente com as Leis Ponderais de Proust para você se garantir no balanceamento das equações químicas.
Exemplos para você dominar o tema:
Vamos ver um exemplo para ficar mais claro! Observe a reação química a seguir:
Al + O2 → Al2O3
Veja que a reação está desequilibrada. Há um átomo de Al nos reagentes, enquanto que nos produtos o número de átomos desse elemento é 2. Algo semelhante ocorre com o O: há dois átomos antes da seta e três átomos de oxigênio após a seta.
Agora, observe que tanto o Al como o O aparecem somente uma vez nos dois membros da equação. Mas, como o O que possui índices maiores (2 e 3), vamos iniciar o balanceamento por ele:
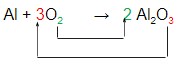
Veja que “trocamos” os índices do oxigênio antes e depois da seta, usando-os como coeficientes. Isso pode ser realizado porque multiplicar 2×3 e 3×2 resulta no mesmo número, facilitando assim o equilíbrio desses átomos.
Agora só falta acertar o Al :
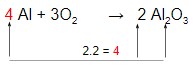
Entendeu? Que tal mais um exemplo para nunca mais esquecer?
![]()
– Seguindo o raciocínio anterior, devemos começar pelo Al, ou com o S ou com o radical ![]() e não com o H ou o O pois aparecem várias vezes não dois membros da equação.
e não com o H ou o O pois aparecem várias vezes não dois membros da equação.
– No entanto, vamos começar pelo ![]() que apresenta índices maiores 1 e 3.
que apresenta índices maiores 1 e 3.
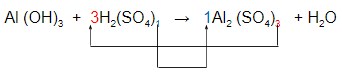
– Prosseguimos com o Al:
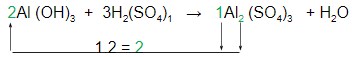
E finalmente, o coeficiente da água pode ser acertado pela contagem dos hidrogênios e dos oxigênios:
![]()
Resumo de Estequiometria
Para entender ainda melhor como fazer o cálculo estequiométrico das equações químicas, assista à videoaula abaixo, com o professor Sobis, de Química!
Exercícios de Balanceamento de Equações Químicas
Para terminar, resolva os exercícios abaixo!
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(Fac. Direito de São Bernardo do Campo SP/2018)
Observe a reação, não balanceada, que representa uma das maneiras de produção do gás cloro.
MnO2(s) + HCl(aq) MnCl2(aq) + H2O(l) + Cl2(g)
Para produção de 3 mols de Cl2 quantos gramas de HCl são necessários?
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem!
-
Pergunta 2 de 10
2. Pergunta
(UNIFOR CE/2018)
O hipoclorito de cálcio, Ca(OCl)2, é usado como um alvejante químico, sendo produzido a partir de hidróxido de sódio, hidróxido de cálcio e cloro de acordo com a equação não balanceada:
NaOH + Ca(OH)2 + Cl2 -> Ca(OCl)2 + NaCl + H2O
Para a produção de 143 toneladas do hipoclorito de cálcio, usaremos aproximadamente as seguintes quantidades, em toneladas, de hidróxido de sódio, hidróxido de cálcio e cloro, respectivamente:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem!
-
Pergunta 3 de 10
3. Pergunta
(Mackenzie SP/2017)
Na reação de neutralização, representada pela equação não balanceada, quando são misturados 444 g de Ca(OH)2 e 294 g de H3PO4,
Ca(OH)2 + H3PO4 -> Ca3(PO4)2 + H2O
Dados: Massas molares, em g mol–1, H2O = 18,
Ca(OH)2 = 74, H3PO4 = 98 e Ca3(PO4)2 = 310é INCORRETO afirmar que
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem!
-
Pergunta 4 de 10
4. Pergunta
(UDESC SC/2017)
A produção de silício de alta pureza, para aplicações tecnológicas, passa por inúmeras etapas, sendo que a etapa final está apresentada pela reação abaixo:
SiCl4 + Mg -> Si + MgCl2
Sobre essa reação, analise as proposições.
I. A reação está balanceada.
II. A reação não está balanceada, sendo os coeficientes estequiométricos para essa reação 1:2:1:2.
III. Ao se utilizar 170,1 g de SiCl4 serão consumidos 48,6 g de magnésio.Assinale a alternativa correta.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem!
-
Pergunta 5 de 10
5. Pergunta
(ENEM/2017)
Os combustíveis de origem fóssil, como o petróleo e o gás natural, geram um sério problema ambiental, devido à liberação de dióxido de carbono durante o processo de combustão. O quadro apresenta as massas molares e as reações de combustão não balanceadas de diferentes combustíveis.
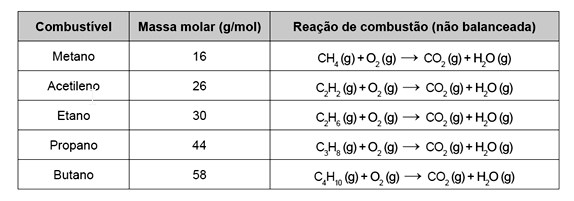
Considerando a combustão completa de 58 g de cada um dos combustíveis listados no quadro, a substância que emite mais CO2 é o
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem!
-
Pergunta 6 de 10
6. Pergunta
(UFAM/2015)
O sulfato de alumínio Al2(SO4)3 é um produto químico amplamente utilizado na indústria de papel e nas estações de tratamento de água. O Al2(SO4)3 pode ser produzido reagindo bauxita, rica em Al2O3, com ácido sulfúrico H2SO4, de acordo com a reação não balanceada:
Al2O3 +H2SO4 -> Al2(SO4)3 + H2O
Partindo-se de 306g de Al2O3 e quantidade de H2SO4 suficiente, a quantidade máxima de Al2(SO4)3 formada é:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem!
-
Pergunta 7 de 10
7. Pergunta
(FPS PE/2015)
A equação de combustão não balanceada da glicose é apresentada a seguir. Qual é a massa, em gramas, de glicose que precisa ser consumida para gerar 54 g de água?
C6H12O6(s) + O2(g) -> CO2(g) + H2O(g)
As massas molares em g/mol são: H = 1; C = 12; O = 16.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem!
-
Pergunta 8 de 10
8. Pergunta
(UNIFOR CE/2013)
Estudos mostram diminuição da massa óssea e risco elevado de fraturas associados ao uso de bebidas carbonatadas, enquanto outros estudos não comprovam tal relação. Bebidas à base de colas contêm cafeína e ácido fosfórico, podendo afetar negativamente a saúde óssea, por meio da geração de carga ácida no organismo; esta é causada pelo ácido fosfórico usado como acidulante nessas bebidas.
(MORAIS, G. Q.; BURGOS, M.G.P. de A.: Rev. Bras. Ortop., 2007; 42 (7).O ácido fosfórico pode ser formado a partir da equação não balanceada:
Ca3(PO4)2 + 3 H2SO4 -> H3PO4 + 3 CaSO4
Partindo-se de 62g de fosfato de cálcio, a massa aproximada de ácido fosfórico obtida é:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem!
-
Pergunta 9 de 10
9. Pergunta
(Unifra RS/2012)
O metanol, CH3OH, usado como combustível, pode ser produzido pela reação do monóxido de carbono com hidrogênio, segundo a equação balanceada
CO(g) + 2H2(g) -> CH3OH(l) .
Suponha que 45,6 g de CO sejam misturadas com 6,20 g de H2. Qual é a massa de metanol, em gramas, que pode ser produzida?
(C = 12; O = 16; H = 1)CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem!
-
Pergunta 10 de 10
10. Pergunta
(UDESC SC/2005)
No processo da fotossíntese a planta absorve gás carbônico (CO2(g)) e libera oxigênio (O2(g)), de acordo com a reação:
6CO2(g) + 6H2O(l) -><- C6H12O6(s) + 6O2(g)
A alternativa correta em relação a esse fenômeno é:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem!

Sobre o(a) autor(a):
Munique Dias - Munique é formada em química pela UFSC, tem mestrado e doutorado em Engenharia Química, também pela UFSC.
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


