Elementos químicos e a origem da ciência química
A Química está presente durante toda a história da evolução dos seres humanos no planeta Terra. E, graças a esta Ciência, a humanidade atingiu inúmeros avanços científicos e tecnológicos. Venha entender a origem da química e se preparar para a prova de Enem!
A Química está voltada para o estudo da composição dos materiais, dos elementos químicos, dos processos pelos quais uma substância se transforma em outra e como ocorrem os fenômenos físicos e químicos na natureza.
Desde a Antiguidade temos vestígios de inúmeros experimentos químicos por meio do domínio e uso do fogo. Através dessas experiências, o homem percebeu que o fogo podia transformar o aspecto e o sabor dos alimentos, além da preservação da qualidade dos mesmos.
A origem da Química
Veja agora com a professora Larissa, do canal do Curso Enem Gratuito, como surgiu a Química enquanto Ciência. Os Métodos Científicos deram lugar à alquimia, e tudo se revolucionou.
As dicas da Larissa:
- Mesmo que a Química só tenha surgido enquanto ciência a partir do século XVII, sua história é bastante antiga.
- Desde o descobrimento do fogo, passando pela alquimia e chegando na lei da conservação de massas, a trajetória da Química é um assunto que, além de muito interessante, pode te fazer compreender muitas coisas ao seu redor.
- Mergulhe mais fundo com a videoaula acima.
O domínio do fogo
O fogo possibilitou ao homem também obter conforto contra o frio e segurança contra predadores. Com o desenvolvimento de técnicas de agricultura, os seres humanos passaram a identificar os ciclos da natureza, explorando novos lugares e aumentando a quantidade de alimentos produzidos.
Nessa época havia também a produção de cerâmica, vidros, tintas, perfumes e a extração de metal a partir de minérios, de forma rudimentar, mas que atendia às necessidades das populações.
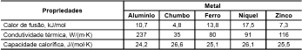
No século V a.C, o filósofo grego Empédocles afirmava que os materiais eram formados por 4 elementos: fogo, terra, ar e água e que estes se distinguiam por sua composição.
O Átomo de Leucipo e Demócrito
Em 400 a.C., Leucipo e Demócrito, dois filósofos gregos, afirmavam que toda matéria presente no universo era composta por átomos, matéria e vácuo. E o que distinguia um material de outro era o tamanho, a forma e o movimento dos átomos destes materiais. Hoje, este trabalho representa a filosofia atômica.
Em 350 a.C., o filósofo grego Aristóteles retomou a ideia dos 4 elementos e afirmava que cada elemento possuía qualidades opostas como: quente – frio, seco – úmido. Para ele, seria possível converter o fogo em terra e a terra em água.
A alquimia e os elementos químicos
No século IX a.C., os alquimistas foram os primeiros cientistas que relataram seus experimentos, onde desejavam obter o elixir da vida eterna.
O objetivo era alcançar a imortalidade e a existência de uma pedra filosofal, capaz de transformar qualquer metal menos nobre – como o chumbo – em ouro. Eles tentavam por meio das características em comum desses elementos transformá-los em outras substâncias.
A alquimia por meio de seus experimentos pode ser considerada como uma das partes fundamentais da origem da Química, pois combinava vários fundamentos da física, química, medicina, metalurgia e religião.
Por volta do Renascimento, marcado pelo experimentalismo, destaca-se o médico Paracelso (1493 – 1541), que afirmava que a finalidade da química era a produção de medicamentos. Nesta época já havia compreensão parcial do funcionamento do corpo humano e de que havia necessidade de se combater certas doenças.
Em 1661, Robert Boyle (1627 – 1691) escreveu o livro: “O químico cético”, lançando a Química como Ciência e conseguiu introduzir o método científico nas pesquisas dos experimentos da época.
O método científico, usado até hoje, representa uma série de etapas que envolvem a observação, hipóteses, leis experimentos e formulação de teorias para se provar uma descoberta.
George Ernest Stahl (1660 – 1734) tentou explicar o processo de combustão por meio da teoria do flogisto, onde todo material que sofria combustão era formado pela cinza e um material chamado de flogístico. Esta teoria não foi muito aceita, pois não tinham como provar que isso realmente ocorria.
As contribuições de Lavoisier
Antoine Laurent Lavoisier (1743 – 1794) derrubou a teoria do flogístico, identificando que quando os materiais entram em combustão, eles reagem com algum componente do ar (que mais tarde ele identificaria como o oxigênio).
Com seus estudos, Lavoisier conseguiu determinar a composição do ar, com valores muito próximos aos que encontramos hoje: 21% de oxigênio e 80% de nitrogênio.
Foi o cientista que introduziu a balança nos experimentos científicos, onde ele pesava quantidades de substâncias antes e após as experiências (reações químicas), observando que a soma das massas dos reagentes é igual a soma das massas dos produtos.
Foi responsável pela criação da Lei da Conservação das Massas, sendo este feito uma revolução para a época, descartando todas as hipóteses anteriores. A partir desta lei, testada e provada experimentalmente, a Química adquiriu uma característica de ciência experimental, provando que as substâncias se transformam em outras substâncias.
Lavoisier é o autor da famosa frase: “Na natureza, nada se cria, nada se perde, tudo se transforma.”
Em 1779, Joseph Louis Proust, através de seus experimentos, verificou que toda substância apresenta uma proporção em massa constante na sua composição, criando a Lei das Proporções Constantes.
Com o avanço das pesquisas, vários elementos químicos foram descobertos e suas características físicas e químicas identificadas, demonstrando realmente que os 4 elementos não eram os constituintes do universo.
Os elementos químicos
Em 1869, Dmitri Ivanovich Mendeleiev (1834 – 1907), criou uma tabela para organizar e agrupar os elementos químicos que já haviam sido descobertos na época, por volta de 63 elementos, de acordo com suas propriedades para facilitar sua classificação.
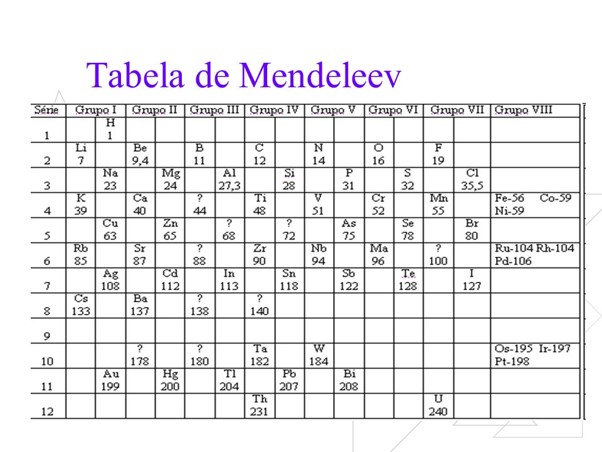
Assim surgia a Tabela Periódica, que hoje contém mais de 100 elementos químicos, divididos em grupos e períodos.Fonte: manualdaquimica.com.br
Vimos até agora a origem e a evolução da Química, sendo esta uma ciência universal, que possui uma linguagem química também universal.
Você já teve a oportunidade de observar os nomes dos elementos químicos e sua simbologia? Sabe por que alguns elementos apresentam símbolos completamente diferentes do seu nome?
Por exemplo, o símbolo do elemento químico prata é Ag. Então vamos estudar agora a simbologia dos elementos químicos e entender como isso ocorre.
A linguagem química é representada por meio de símbolos, fórmulas químicas, estruturas moleculares, modelos atômicos, etc.
Os elementos químicos foram descobertos por cientistas de diferentes países em períodos diversos, e sua nomenclatura deveria ter um padrão específico de representação. Assim, foi escolhido o latim como padrão de nomenclatura e simbologia para os diversos elementos químicos.
Resumo sobre a Tabela Periódica
Veja agora com o professor Felipe Sobis, um campeão da Química na Internet, os fundamentos para a organização dos elementos químicos na Tabela Periódica de Mendelev.
Nomeando os elementos químicos
Em 1813, o químico sueco Berzelius (1779 – 1848) introduziu a notação científica para os elementos químicos, determinando que os elementos seriam representados pela letra inicial de seu nome em latim e em letra maiúscula.
Não há elemento químico com o mesmo símbolo, pois caso ocorram elementos químicos que contenham a mesma letra inicial, deve-se acrescentar a segunda letra, em minúscula.
Então vamos utilizar como exemplo o elemento carbono: seu nome em latim é Carbonium e sua simbologia é a letra C. Temos também o elemento cálcio, onde seu nome em latim é Calcium e sua simbologia é Ca.
Temos outros elementos em que seu nome não coincide com a letra inicial em nosso idioma, pois ele é retirado do latim:
- Na (natrium) – sódio
- K (kalium) – potássio
- S (sulfur) – enxofre
- P (phosphorus) – fósforo
- Ag (argentum) – prata
- Au (aurum) – ouro
- Cu (cuprum) – cobre
- Sn (stannum) – estanho
- Pb (plumbum) – chumbo
- Hg (hydrargyrum) – mercúrio
Para pronunciarmos os símbolos químicos, devemos soletrar cada letra separadamente.
Nas fórmulas químicas são representados os símbolos dos elementos que estão em sua composição e seus respectivos números, que indicam a quantidade de átomos de cada elemento presente na substância.
Assim, a fórmula química de uma substância tem significado qualitativo, pois indica quais elementos fazem parte de sua estrutura, e também um aspecto quantitativo, pois determina a quantidade de átomos presentes na molécula. Podemos utilizar por exemplo a fórmula da água:
H2O, onde temos a simbologia do elemento hidrogênio (H) e do elemento oxigênio (O), e também nesta fórmula temos 2 átomos de hidrogênio e 1 átomo de oxigênio.
Exercícios sobre a origem da Química
Teste agora os seus conhecimentos.
.