Ligação iônica: como ocorre, características e fórmulas
Ligação iônica é aquela estabelecida entre dois átomos que resulta na formação de íons. Entenda como ela ocorre, saiba quais são as principais ligações iônicas e suas características neste resumo de Química.
Partindo da ideia de estabilidade mostrada pelos gases nobres (a camada de valência completa), certos átomos necessitam doar ou receber elétrons para que adquiram a mesma configuração dos gases nobres.
Sendo assim, caso o átomo perca ou ganhe elétrons para estabelecer uma ligação com outro átomo a fim de se igualar aos gases nobres, ele formará um íon.
Dessa maneira, a ligação estabelecida entre dois átomos que resulta na formação de íons é chamada de ligação iônica.
Como ocorre uma ligação iônica
A ligação iônica ocorre entre íons, positivos (cátions) e negativos (ânions). É caracterizada pela existência de forças de atração eletrostática entre os íons e ocorre entre elementos que apresentam tendências opostas, ou seja, é necessário que um dos átomos participantes da ligação possua a tendência de perder elétrons enquanto o outro, a de receber elétrons.
Como regra, os elementos com maior probabilidade de formar cátions em compostos iônicos são os metais alcalinos e alcalino-terrosos e os elementos com maior probabilidade de formar ânions são os halogênios e o oxigênio. Assim, uma vasta gama de compostos iônicos combina um metal do grupo 1 ou do grupo 2 com um halogênio ou com oxigênio.
A ligação iônica é a única em que ocorre transferência definitiva de elétrons.
Para entender melhor o conceito, vamos ver um exemplo?
A formação do sal de cozinha (cloreto de sódio) é um bom exemplo de ligação iônica entre o átomo de sódio (Na) e Cloro (Cl).
O átomo de sódio (Na) não é estável pela Teoria do Octeto, pois apresenta um elétron na camada de valência. Sua estabilidade eletrônica será atingida pela perda de um elétron, originando o íon Na+.
O átomo de cloro (Cl) não é estável pela Teoria do Octeto, pois apresenta sete elétrons na camada de valência. Sua estabilidade eletrônica será atingida pelo ganho de um elétron, originando o íon Cl–. Observe:

Após a formação dos íons (Na+ e Cl–) eletronicamente estáveis, ocorre uma interação eletrostática (cargas com sinal contrário se atraem):
Na+ + Cl– → NaCl
Os compostos formados por ligações iônicas são chamados compostos iônicos e são eletricamente neutros.
A interação entre os íons produz aglomerados com forma geométrica definida, denominados retículos cristalinos, característicos dos sólidos.

Figura 2. Retículo cristalino formado pelo composto iônico Cloreto de sódio.
Características dos compostos iônicos:
a) Como apresentam forma definida, são sólidos nas condições ambientes (temperatura de 25°C e pressão de 1 atm).
b) Os compostos iônicos apresentam elevadas temperatura de fusão e temperatura de ebulição.
c) Quando submetidos a impacto, quebram facilmente, produzindo faces planas; são, portanto, duros e quebradiços.
d) Apresentam condutibilidade elétrica quando dissolvidos em água ou quando puros no estado líquido (fundidos), devido à existência de íons com liberdade de movimento, que podem ser atraídos pelos eletrodos, fechando o circuito elétrico.
e) Seu melhor solvente é a água.
Fórmula dos compostos iônicos:
A fórmula correta de um composto iônico é aquela que mostra a mínima proporção entre os átomos que se ligam, de modo que se forme um sistema eletricamente neutro. Para que isso ocorra, é necessário que o número de elétrons cedidos pelos átomos de um elemento seja igual ao número de elétrons recebidos pelos átomos do outro elemento.
Que tal conhecer uma maneira prática e rápida, de determinar a quantidade necessária de cada íon para escrever a fórmula iônica correta? Veja o esquema:

Agora que você já revisou tudo sobre as ligações iônicas, veja a diferença entre elas e as ligações covalentes:

Videoaula sobre ligações químicas
Para terminar, assista ao resumo em vídeo sobre ligações químicas:Exercícios
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(UDESC SC/2018)
Ao se analisar o caráter iônico entre dois átomos diferentes, formadores de uma ligação, é necessário verificar a eletronegatividade.
Assinale a alternativa que apresenta o composto químico com o caráter iônico mais acentuado.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 2 de 10
2. Pergunta
(IBMEC SP Insper/2017)
Um professor entregou a cada aluno o nome de um personagem da série de TV Game of Thrones®. Em seguida, solicitou que cada aluno utilizasse as letras do nome do personagem para escrever símbolos de elementos químicos, comparar propriedades periódicas desses elementos e construir as fórmulas dos possíveis compostos formados por eles. Só valiam os símbolos formados pela leitura feita da esquerda para a direita e com letras subsequentes.
Um dos alunos recebeu o nome do personagem Bran Stark. Para esse personagem, o elemento com maior raio atômico representado pelas letras do nome e sobrenome e a fórmula do composto iônico formado pelos símbolos contidos nas letras do sobrenome são, respectivamente,CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 3 de 10
3. Pergunta
(FPS PE/2017)
O amianto foi um material muito empregado como matéria-prima na fabricação de materiais isolantes usados na construção civil, como o fibrocimento. O uso dessa fibra está em queda desde 1960, quando estudos confirmaram os efeitos cancerígenos desse material, principalmente sobre o aparelho respiratório. Entre os seus componentes, estão o dióxido de silício, SiO2, e o óxido de magnésio, MgO. Com relação aos compostos SiO2 e MgO, considere as afirmações seguintes.
1. Na ligação entre o magnésio (metal alcalino terroso) e o oxigênio (calcogênio), há formação de um cátion Mg2+ e um ânion O2–, sendo classificada como ligação iônica.
2. Devido à posição do Si, na tabela periódica (família do carbono), as ligações entre o silício e os átomos de oxigênio são consideradas covalentes.
3. Em ambos os casos, a ligação entre os átomos do MgO e do SiO2 é realizada através da interação entre cargas positivas e negativas, ou seja, ligações iônicas.
Dados: Mg (Z = 12); Si (Z = 14); O (Z = 8)Está(ão) correta(s):
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 4 de 10
4. Pergunta
(Mackenzie SP/2017)
Em dezembro de 2016, a IUPAC (International Union of Pure and Applied Chemistry) oficializou a nomenclatura dos novos elementos químicos, presentes no sétimo período da tabela periódica. Assim, os elementos 113 (grupo 13), 115 (grupo 15), 117 (grupo 17) e 118 (grupo 18) passaram a ser denominados, respectivamente, de Nihonium (Nh), Moscovium (Mc), Tennessine (Ts) e Oganesson (Og).
Pode-se afirmar que o elemento
Dado: Número atômico (Z): O = 8
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 5 de 10
5. Pergunta
(UFRGS RS/2017)
Os elementos X, Y e Z apresentam as seguintes configurações eletrônicas:
X: 1s²2s²2p63s¹
Y: 1s²2s²2p63s²3p5
Z: 1s²2s²2p6A respeito desses elementos, pode-se afirmar que
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 6 de 10
6. Pergunta
(Centro Universitário de Franca SP/2016)
O suco detox, forma reduzida da palavra “detoxification”, é uma bebida consumida por muitas pessoas que visam o emagrecimento ou o consumo de alimentos saudáveis. Um dos ingredientes mais utilizados na preparação deste suco é a couve-manteiga, cujo valor nutricional para 100 g é apresentado a seguir:
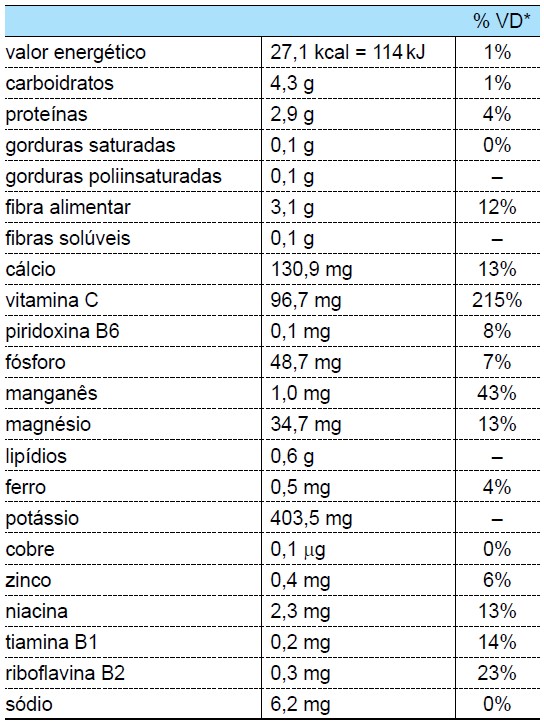
* % Valores diários com base em uma dieta de 2 000 kcal ou 8 400 kJ.
(www.tabelanutricional.com.br)A combinação entre cloro e um dos elementos da tabela nutricional com 13% VD ocorre por meio de ligação __________, resultando no composto de fórmula __________.
Assinale a alternativa que preenche correta e respectivamente as lacunas.CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 7 de 10
7. Pergunta
(FATEC SP/2016)
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
• Folha de papel
• Pincel fino
• Difusor
• Solução de fenolftaleína
• Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcioProcedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.Explicação
A fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
http://tinyurl.com/o2vav8v> Acesso em: 31.08.15. Adaptado.As soluções de NaOH ou Ca(OH)2, apresentam soluto de caráter
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 8 de 10
8. Pergunta
(CEFET MG/2016)
Ao reagir um metal alcalino-terroso do terceiro período da Tabela Periódica dos Elementos com um halogênio do segundo período forma-se um composto _______________ de fórmula ____________.
Os termos que completam corretamente as lacunas são, respectivamente,CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 9 de 10
9. Pergunta
(UNIRG TO/2016)
Os elementos químicos genéricos, X e Y, apresentam as seguintes distribuições eletrônicas:
X = 1s² 2s² 2p6 3s¹
Y = 1s² 2s² 2p6 3s² 3p¹
Suponha que os dois elementos reajam com o cloro. De acordo com as distribuições eletrônicas e as respectivas estruturas de Lewis, as fórmulas moleculares desses compostos serão:CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 10 de 10
10. Pergunta
(EsPCEX/2015)
Compostos iônicos são aqueles que apresentam ligação iônica. A ligação iônica é a ligação entre íons positivos e negativos, unidos por forças de atração eletrostática. (Texto adaptado de: Usberco, João e Salvador, Edgard, Química: química geral, vol 1, pág 225, Saraiva, 2009).
Sobre as propriedades e características de compostos iônicos são feitas as seguintes afirmativas:I. apresentam brilho metálico.
II. apresentam elevadas temperaturas de fusão e ebulição.
III. apresentam boa condutibilidade elétrica quando em solução aquosa.
IV. são sólidos nas condições ambiente (25 ºC e 1 atm).
V. são pouco solúveis em solventes polares como a água.Das afirmativas apresentadas estão corretas apenas
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!

Sobre o(a) autor(a):
Roseli Prieto - Texto elaborado por Roseli Prieto, professora de Química e Biologia da rede estadual de São Paulo. Já atuou em diversas escolas públicas e privadas de Santos (SP). É Gestora Ambiental e Especialista em Planejamento e Gestora de cursos a distância.
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


