Massa atômica, massa molecular e massa molar
A Química está relacionada com as propriedades e as transformações que a matéria pode sofrer em seus diferentes estados. Para que esses fenômenos ocorram, os químicos necessitam utilizar grandezas e unidades de medidas específicas. Então venha estudar conosco e se preparar para a prova do Enem!
Em nosso dia a dia, fazemos inúmeros cálculos para comprar pão, carne, legumes e para medirmos quantidades. Todos esses cálculos podem ser observados e pesados, mas, na Química, necessitamos ter um padrão para medir a massa dos átomos.
Você vai aprender agora o que é massa atômica, molecular e molar. Primeiramente, sabemos que os átomos são muito pequenos para medi-los em uma balança.
Como resultado, surgiram as grandezas químicas. Elas se relacionam com a massa, volume, número de átomos, moléculas e em quantidades expressas em mols.
O elemento padrão
Os cientistas escolheram para ser padrão de massa dentro da tabela periódica o elemento carbono. Isso ocorreu por ser um dos elementos químicos mais abundantes no universo, além de sua representação nos compostos orgânicos.
Nesse sentido, foi escolhido como padrão de massa atômica o carbono 12. O átomo de carbono foi dividido em 12 partes iguais e os cientistas escolheram uma parte das 12 para ser a unidade de massa atômica (u).
Assim, uma unidade de massa atômica equivale a 1/12 da massa do isótopo do carbono 12.
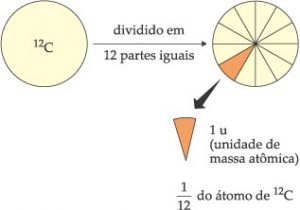
Portanto, as massas de todos os átomos serão comparadas com este padrão de 1u. A massa atômica representa a massa de um único átomo e indica quantas vezes o átomo é mais pesado que 1/12 do carbono 12.
Ou seja, todas as medições tem como base de comparação 1/12 do carbono.
Ao mesmo tempo, foi necessário criar um equipamento específico para essa mensuração. Dessa forma, surgiu o aparelho denominado espectrômetro de massa. Ele podia mensurar as medidas como, por exemplo, a massa de átomos e moléculas.
Introdução sobre massa atômica, massa molecular e massa molar com o professor de química Felipe Sobis, do canal do Curso Enem Gratuito:
Como descobrir a massa atômica?
A massa atômica está localizada abaixo do símbolo dos elementos na tabela periódica. Assim, se um vestibular fornecer a tabela periódica, você será capaz de descobrir a massa atômica dos elementos.
Porém, a maioria das provas não fornece esse tipo de informação. Portanto, você terá que descobrir de outras maneiras, que geralmente envolvem cálculos. Vamos ver como podemos descobrir.
Caso um elemento químico possua vários isótopos, sua massa atômica será a média ponderada das massas atômicas desses isótopos.
Olhando na tabela periódica e analisando um elemento qualquer como o magnésio, por exemplo, verificamos que esse elemento tem massa igual a 24u. Como resultado, isso significa dizer que o magnésio é 24 vezes mais pesado que o 1/12 do carbono 12.
Na natureza, a grande maioria dos átomos não se encontram isolados, mas combinados por meio de ligações iônicas e covalentes, formando moléculas. Em outras palavras, precisamos entender também o que é massa molecular.
Massa molecular
Assim, iremos calcular a massa molecular do composto formado, por meio da soma das massas atômicas de cada elemento presente na fórmula.
Nesse sentido, devemos sempre levar em consideração a quantidade de cada um dos elementos presentes.
Então vamos fazer alguns exemplos para ficar mais claro?
1) H2O onde: H = 1u e O = 16u
Nesse exemplo temos que: H = 1 x 2 = 2. Como resultado, temos 2 átomos de hidrogênio. Logo devemos multiplicar sua massa atômica pela quantidade de átomos.
O = 16 x 1 = 16. Ou seja, só temos 1 átomo de oxigênio na fórmula.
Agora iremos somar os 2 valores para obter o resultado final: 2 + 16 = 18u
2) H2SO4 onde: H = 1u, S = 32u e O = 16u
H = 1 x 2 = 2
S = 32 x 1 = 32
O = 16 x 4 = 64
Portanto, temos como resultado final temos que a massa molecular é igual a 98u.
3) C6H12O6 onde: C = 12u, H= 1u, O = 16u
C = 12 x 6 = 72
H = 1 x 12 = 12
O = 16 x 6 = 96
Como resultado, temos que a massa molecular é igual a 180u.
Sabendo que a massa atômica da prata é igual 108u, podemos afirmar que 1 átomo de prata pesa: 108 vezes mais que 1/12 do átomo de carbono 12 ou 9 vezes mais que um átomo de carbono 12.
Resumindo:
Podemos afirmar que a massa molecular é a massa da molécula expressa em u. A massa molecular é numericamente igual à soma das massas atômicas de todos os átomos da molécula, e indica quantas vezes a molécula pesa mais que 1/12 do átomo de carbono 12.
Como contar a quantidade de átomos presentes em um elemento químico?
As massas atômicas de todos os elementos quando expressas em gramas, irão conter o mesmo número de átomos. Assim como as massas moleculares de todas as substâncias quando expressas em gramas, irão conter o mesmo número de moléculas.
Essas relações foram observadas e estudadas pelo cientista Amedeo Avogadro, que não conseguiu determinar este número.
Posteriormente, outros pesquisadores descobriram e nomearam este número em homenagem a Avogadro, como constante de Avogadro, que é igual a 6,02 x 10²³. Ela relaciona a quantidade de matéria com o número de átomos.
Assim, podemos dizer que existem:
6,02 x 10²³ átomos de S em 32g de S, bem como 6,02 x 10²³ átomos de O em 16g de O, além de 6,02 x 10²³ moléculas de H2O em 18g de H2O e infinitos exemplos.
Massa Molar
A massa molar representa a massa de 1 mol de átomos, moléculas, íons, e é expressa em g/mol, onde o mol expressa uma quantidade de matéria que contém 6,02 x 10²³ partículas.
Resumo sobre Massa Molar
Podemos fazer uma representação da seguinte maneira:
1 mol de íons = 6,02 x 10²³ íons, assim como 1 mol de átomos = 6,02 x 10²³ átomos. Assim como em 1 mol de Ca, que é igual a 20g, existem 6,02 x 10²³ átomos e em 1 mol de HNO3, temos 63g e 6,02 x 10²³ moléculas.
Muito confuso? Vamos fazer dois exemplos:
Em 180g de H2O teremos:
a) quantos mol?
Primeiro vamos calcular a massa molar da água:
H = 1 x2 = 2
O = 16 x 1 = 16
Portanto, MM = 18g/mol.
Agora vamos utilizar regra de 3:
1 mol ____ 18 g/mol
x _____ 180g/mol
x = 10 mol
b) quantas moléculas?
1 mol ______ 6 x 10²³ moléculas
10 mol _____ x
x = 60 x 10²³ moléculas ou 6,0 x 1024.
c) quantos átomos de hidrogênio?
1 molécula de H2O ____ 2 átomos de H
6,0 x 1024 moléculas _______ x
X = 12 x 1024 átomos de H ou 1,2 x 1025 átomos de H.
d) quantos átomos de oxigênio?
1 molécula de H2O ____ 1 átomo de O
6 x 1024 moléculas _____ x
x = 6 x 1024 átomos de O.
Aprenda a resolver questões de Mol:
2) Em uma restauração dentária, foi usada uma amálgama que continha cerca de 40% em massa de mercúrio. Ao usar 1,0g dessa amálgama no tratamento, quantos átomos de mercúrio serão colocados na cavidade dentária?
Dados: massa molar do Hg = 200g/mol
a) 2 x 10–³
b) 5 x 10–³
c) 1,2 x 10²¹
d) 3,0 x 10²¹
Resolução:
Em primeiro lugar, devemos pensar no total de 100% em relação aos 40%:
1 g _____ 100%
x _____ 40%
x = 0,4g de mercúrio.
1 mol ___ 200g ____ 6 x 10²³ átomos
200 g _____ 6 x 10²³
0,4 g _____ x
200 g = 0,4 x 6 x 10²³
200 g = 2,4 x 10²³
x = 0,012 x 10²³
X = 1,2 x 10²¹ átomos (andamos com a vírgula para a direita = potência diminui).
Devemos relacionar o mol com a massa molar e com o número de átomos, que é o que iremos calcular no problema.
Portanto, temos como gabarito a letra C.
Agora vamos fazer mais alguns exercícios?
1) (Mackenzie)
Em 600g de H2O, existem: Dadas as massas molares (g/mol): H=1 e O=16
a) 2,0.10²5 moléculas.
b) 18 moléculas.
c) 6,0.10²³ moléculas
d) 16 moléculas
e) 3 moléculas.
gabarito: A
2) (Fuvest)
O minério usado na fabricação de ferro em algumas siderúrgicas brasileiras contém cerca de 80% de óxido de ferro (III). Quantas toneladas de ferro podem ser obtidas pela redução de 20 toneladas desse minério? (Dados: Massas molares: Fe = 56g/mol; O = 16g/mol)
a) 11,2
b) 11,6.
c) 12,4.
d) 14,0.
e) 16,0.
gabarito: A
3) (UEL-PR)
Assinale a opção que apresenta as massas moleculares dos seguintes compostos: C6H12O6; Ca3(PO4)2 e Ca(OH)2, respectivamente:
Dados: H = 1 u; C = 12 u; O = 16 u; Ca = 40 u; P = 31 u.
a) 180, 310 e 74.
b) 150, 340 e 73.
c) 180, 150 e 74.
d) 200, 214 e 58.
e) 180, 310 e 55.
gabarito: E





