pH: saiba como calcular a acidez ou a basicidade de um meio
Revise o pH, que é um dos dez temas essenciais para gabaritar Química e elevar sua nota em Ciências da Natureza. Estude com o Curso Enem Gratuito!
A concentração de íons H+, chamada de concentração hidrogeniônica, indica se uma solução é ácida ou básica. O pH é utilizado como uma forma quantitativa de exprimir a acidez ou a basicidade de um meio.
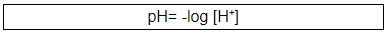
O pH é o logaritmo negativo da concentração hidrogeniônica, tal logaritmo é decimal, ou seja, na base 10. Entendeu? Vamos ver alguns exemplos na tabela a seguir:
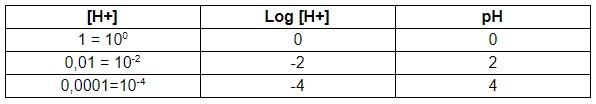
Quanto mais alta for a acidez de uma solução, mais baixo será o pH. Genericamente: [H+] = 10-x mol/L. Então, pH = X.
A fim de entender melhor a definição de pH e saber como calculá-lo, confira a videoaula do nosso canal. Em seguida, continue com a aula para aprofundar seus conhecimentos e testar o que aprendeu com os exercícios.
Água “pura” e pH
Vamos considerar o equilíbrio de ionização da água:
H2O ↔ H+ + OH–
Na água “pura”:
[H+] = [OH–]
log 10-14 = 2log[H+]
-log 10-14 = -2log[H+]
Como -log [H+] = pH, temos:
+14 = 2 . pH → pH = 7
Kw = 10-14 = [H+] . [OH–] (a 25ºC)
Então: 10-14 = [H+]²
Vale relembrar!
- Log a.b = log a + log b
- Log ax = x log a
- Log a/b = log a – log b
Analogamente, podemos definir o pOH de uma solução por:
pOH = -log [OH-]
Portanto, na água “pura”, temos:
pH = pOH = 7
Soluções ácidas
Em soluções ácidas, a concentração de H+ é mais alta do que a de OH-, já que ácido fornece o H+. Então, aplicando as propriedades dos logaritmos, como fizemos anteriormente, temos:
Soluções ácidas
pH <7 pOH >7
Soluções básicas
Em soluções básicas temos:
pH>7
pOH <7
A figura abaixo mostra alguns valores de substâncias do nosso cotidiano:

Fonte: http://andre-godinho-cfq-8a.blogspot.com.br/2012/12/escala-de-ph.html
Exercícios sobre pH
Para finalizar sua revisão, resolva exercícios que já caíram no Enem e em vestibulares:
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(FUVEST SP/2017)
Dependendo do pH do solo, os nutrientes nele existentes podem sofrer transformações químicas que dificultam sua absorção pelas plantas. O quadro mostra algumas dessas transformações, em função do pH do solo.
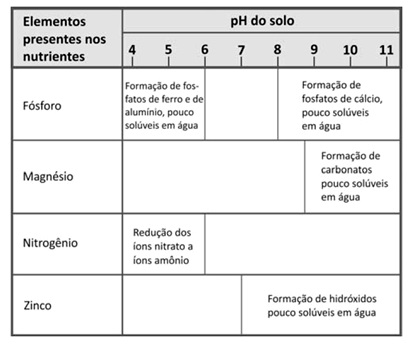
Para que o solo possa fornecer todos os elementos citados na tabela, o seu pH deverá estar entre
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 2 de 10
2. Pergunta
(FCM PB/2017)
Na Floresta Amazônica, os valores de pH da água da chuva são próximos dos observados em regiões urbanas e industrializadas, como as cidades do Rio de Janeiro e de São Paulo, com elevados índices de acidez, que são atribuídos, principalmente, a dois fatores:
– Formação de H2SO4(aq) proveniente da oxidação de H2S(g), que se volatiliza dos alagados da região;
– Formação de HCOOH(aq) e H3CCOOH(aq) provenientes dos resíduos da queima da biomassa, que tem sido intensa há 20 anos.
Com base nas informações, assinale a alternativa correta.
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 3 de 10
3. Pergunta
(IFAL/2017)
O potencial de hidrogênio (pH) das soluções é dado pela função: pH = –log[H+], onde [H+] é a concentração do cátion H+ ou H3O+ na solução. Se, em uma solução, a concentração de H+ é 2.10-8, qual o pH dessa solução? Adote: log 2 = 0,3.
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 4 de 10
4. Pergunta
(FCM MG/2017)
Os pH’s das soluções de NH4Cl, CH3COOK, NaHCO3 e LiNO3 podem ser, respectivamente:
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 5 de 10
5. Pergunta
(IFPE/2017)
A escala de pH foi formulada a partir de cálculos matemáticos que expressam a concentração de íons hidrogeniônicos (H3O+) em uma solução. A 25º C, as soluções neutras apresentam pH igual a 7; as ácidas, abaixo de 7; as básicas ou alcalinas, acima de 7. O pH da solução depende da concentração do composto dissolvido e de seu grau de ionização ou dissociação. Na tabela, apresentada abaixo, encontram-se três soluções com concentrações idênticas e com seus valores de pH.

Assinale a alternativa CORRETA em relação às soluções apresentadas na tabela acima.
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 6 de 10
6. Pergunta
(UEFS BA/2017)

O risco de morte pela variação do pH sanguíneo acontece quando o valor do pH chega próximo a 6,8, no caso de acidose, e a 7,8, no caso de alcalose. A variação da concentração dos íons H+ no intervalo de pH de 6,8 a 7,8 corresponde a
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 7 de 10
7. Pergunta
(PUC Camp SP/2017)
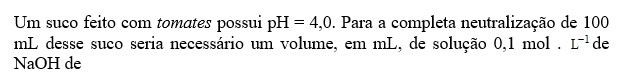 Correto
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 8 de 10
8. Pergunta
(FUVEST SP/2016)
Dispõe-se de 2 litros de uma solução aquosa de soda cáustica que apresenta pH 9. O volume de água, em litros, que deve ser adicionado a esses 2 litros para que a solução resultante apresente pH 8 é
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 9 de 10
9. Pergunta
(UNIRG TO/2016)
O pH da água de chuva comum está em torno de 5,5. Uma amostra de água de chuva de uma região industrializada apresentou pH igual a 4,5.
Assinale a única alternativa correta com relação aos dados apresentados.
CorretoParabéns! Siga para a próxima questão.
-
Pergunta 10 de 10
10. Pergunta
(PUC RS/2016)
Os indicadores ácido-base são úteis para se obter informações sobre o pH de soluções. Alguns, como o extrato de repolho roxo, podem ser preparados facilmente por qualquer pessoa na cozinha. Outros, como o tornassol, a fenolftaleína e o alaranjado de metila, são mais usados em laboratórios. Eles apresentam uma cor em pH ácido, outra cor em pH básico, e tonalidades intermediárias em uma faixa limitada de pH (faixa de mudança de cor), conforme pode ser observado na tabela.

De acordo com as informações acima, é correto afirmar:
CorretoParabéns! Siga para a próxima questão.
Sobre o(a) autor(a):
Martha Ramos -
Gostou? Compartilhe!
Continue lendo:
Aqui vão 2 publicações relacionadas que talvez você goste:

Aulão Enem de Química: revisão intensiva e gratuita para a prova
Por João Vianney dos Valles Santos | 11 de outubro
Assista ao Aulão Enem de Química do Curso Enem Gratuito e revise os conteúdos mais importantes para a prova.

Monitoria Gratuita do Ensino Médio: aulas de outubro
Por Melina Zanotto | 30 de setembro
O calendário da Monitoria Gratuita do Ensino Médio com as aulas do mês de outubro já está disponível. Programe-se e...


