Reações Consecutivas
Você sabia que as reações consecutivas estão relacionadas aos processos industriais de produção de substâncias químicas? Então venha estudar conosco e aumente seus conhecimentos de Química para o Enem!
As reações consecutivas estão relacionadas às reações químicas, e para compreendê-las melhor, precisamos recordar o cálculo estequiométrico.
O cálculo estequiométrico é usado para determinar a quantidade de reagentes necessários para produzir uma certa quantidade de produtos. Assim, o cálculo estequiométrico relaciona-se com a quantidade de substâncias envolvidas em uma reação química.
No cálculo estequiométrico relacionamos mol, massa, volume e número de moléculas. Para isso devemos seguir alguns procedimentos básicos:
a) Representar a equação química;
b) Fazer o balanceamento da equação química, informando a quantidade de átomos envolvidos na reação. Lembre-se que sempre temos que ter o mesmo número de átomos dos elementos em cada lado da equação. Ou seja, a quantidade de certo elemento reagente deve ser igual à sua quantidade como produto.
c) Acertar os coeficientes da reação, estes, representam a proporção em mol dos participantes da reação.
d) Estabelecer uma regra de três entre os elementos solicitados no texto.
Para entendermos melhor, vejamos um exemplo:
Observe a reação: C + O2 → CO2
Nesta equação observamos que:
– Há 1 átomo de C e 2 átomos de O como reagentes.
– Como produtos temos: 1 átomo de C e 2 átomos de O. Sendo assim, a equação está balanceada.
Veja ainda esta outra reação: H2 + O2 → H2O
Nesta equação temos: 2 átomos de H e 2 átomos de O como reagentes. Nos produtos temos: 2 átomos de H e 1 átomo de O; as quantidades de O estão diferentes, então esta equação não está balanceada.
Para fazer seu balanceamento, colocamos o número 2 na frente da molécula de água (H2O), pois há 2 átomos de O nos reagentes. O número 2 irá multiplicar todos os elementos químicos da molécula, ou seja, multiplica o Hidrogênio e o Oxigênio. Veja:
H2 + O2 → 2 H2O
Agora temos 4 átomos de H nos produtos, precisamos igualar sua quantidade nos reagentes, assim, iremos multiplicar a molécula de H2 por 2, obtendo:
2 H2 + O2 → 2 H2O
Assim temos: 4 átomos de H e 2 átomos de O nos reagentes; e 4 átomos de H e 2 átomos de O nos produtos, a equação está balanceada.
Vamos fazer um exemplo juntos?
Calcule o número de mols de moléculas de O2, necessário para reagir com 5 mols de átomos de ferro.
Fe + O2 → Fe2O3
Resolução: O exercício nos deu a nossa equação inicial. Para resolver, primeiramente vamos observar a quantidade de átomos de cada lado da reação. A partir disso, podemos perceber que os elementos químicos estão com quantidades diferentes. Sendo assim, teremos que igualar suas quantidades. Como faremos isso?
Podemos usar o método de tentativas: cada átomo de O tem um número diferente, assim iremos multiplicar o oxigênio dos reagentes por 3 (que é a quantidade dos produtos), e multiplicar o oxigênio dos produtos por 2 (que é a quantidade dos reagentes).
Ficaremos com 4 átomos de ferro nos produtos, e iremos multiplicar o ferro dos reagentes por 4. Teremos a equação balanceada:
4 Fe + 3 O2 → 2 Fe2O3
voltando ao enunciado: vamos relacionar O2 com Fe:
4 Fe ———– 3 O2
4 mols ———– 3 mols
5 mols ———– x
4 x = 15
x = 3,75 mols
Reações Consecutivas
Agora que relembramos como fazer o balanceamento das equações, podemos partir para nosso assunto. Algumas reações químicas ocorrem em várias etapas, envolvendo elementos em comum. Uma reação é consequência de outra reação. Isto é, o produto de uma reação é usado como reagente em outra reação.
Para compreendê-las, deve-se somar todas as reações para se chegar em uma única reação química. Dessa maneira, como dito acima, para resolver questões sobre reações consecutivas devemos empregar os tópicos relacionados ao cálculo estequiométrico.
Vamos entender melhor? Veja um exemplo:
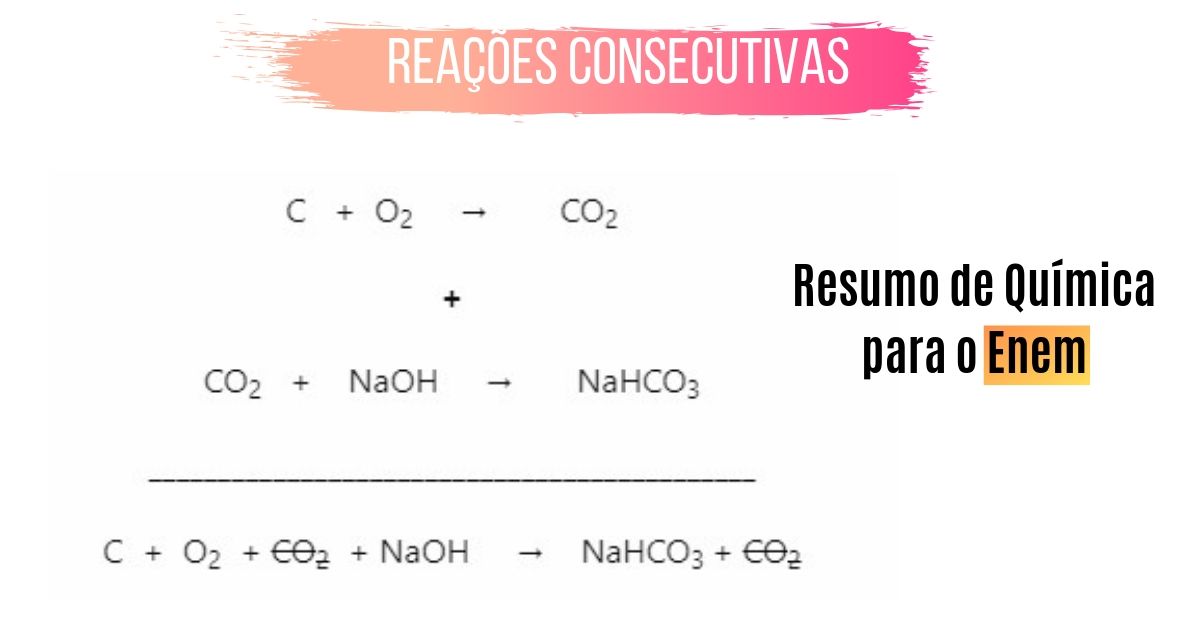
(Fuvest) Pela sequência da reação:
C + O2 → CO2
CO2 + NaOH → NaHCO3
Determinar a massa de NaHCO3 (hidrogenocarbonato de sódio) que se pode obter a partir de 1,0g de carbono.
Dados: massas molares em g/mol H = 1; C = 12; O = 16; Na = 23
a) 3,7g
b) 4,3g
c) 7,og
d) 8,4g
Resolução:
Primeiro devemos observar se a equação está balanceada: nas 2 equações temos a mesma quantidade de átomos nos dois lados das reações.
Agora, como iremos formar uma única reação?
Na primeira equação temos como produto o CO2. Na segunda equação, o mesmo CO2 aparece como reagente. Pela definição de reação consecutiva, temos um elemento em comum, que pode ser eliminado da equação. A equação ficará esquematizada da seguinte maneira:
C + O2 → CO2
+
CO2 + NaOH → NaHCO3
____________________________________________
C + O2 + CO2 + NaOH → NaHCO3 + CO2
A equação final após cortar os CO2 de cada lado será:
C + O2 + NaOH → NaHCO3
Cálculo da massa de NaHCO3:
Na = 23
H = 1
C = 12
O = 16 . 3 = 48
Total: 84g
Assim:
1 mol de C —— 1 mol de NaHCO3
12 g ——– 84 g
1,0g ——— x
12 x = 84
x = 7g de NaHCO3
Viu, como é fácil? Não tem motivo para ter medo das reações consecutivas, apesar de elas parecerem grandes. Lembre-se sempre de fazer o balanceamento e cortar os reagentes e produtos iguais que estão dos dois lados da seta (como fizemos com o CO2 na reação acima), só não esqueça que eles precisam estar na mesma proporção!
Vamos aumentar os conhecimentos? Assista ao vídeo
Agora resolva os exercícios que preparei para você (alguns com uma ajudinha minha)
1) (Fuvest) Qual a massa de água formada a partir de 620 g de Na2O?
Dados: massas molares: Na = 23; H = 1; O = 16
Na2O + H2O → 2 NaOH
2 NaOH + 2 HCl → 2 NaCl + 2 H2O
Resolução:
As 2 reações estão balanceadas. Passamos para a próxima etapa, que é verificar qual elemento está como reagente e como produto: O NaOH na primeira reação está como produto, e na segunda reação está como reagente, o que caracteriza uma reação consecutiva. Como estão na mesma quantidade podem ser eliminados da reação. A equação final ficará representada;
Na2O + H2O + 2 HCl → 2 NaCl + 2 H2O
Perceba que não cortamos a água, já que a sua proporção está diferente.
Vamos relacionar:
Na2O —— 2 H2O
1 mol Na2O ——– 2 mols H2O
62 g ——— 2. 18 g = 36 g
620 g ———- x
62 x = 620 . 36
x = 360 g H2O
2) (Unifesp) Qual a massa de ácido sulfídrico produzido a partir de 219 g de ácido clorídrico?
Dados massas molares: H = 1; S = 32; Cl = 35,5
2 HCl + Ca(OH)2 → CaCl2 + 2 H2O
Na2S + CaCl2 → 2 NaCl + CaS
CaS + 2 H2O → Ca(OH)2 + H2S
Resolução: observar sempre se as reações estão balanceadas. Neste exercício, elas estão ok.
Temos na primeira reação o CaCl2 como produto, e na segunda reação esta substância está como reagente. Na segunda reação temos o CaS como produto, e este está na terceira reação como reagente.Observamos também que todos estes elementos citados se encontram com as mesmas quantidades. Assim a equação final será:
2 HCl + Na2S → 2 NaCl + H2S
Assim relacionamos:
2 HCl —— H2S
2 mols ——- 1 mol
Calculando a massa molar do HCl (1×1 + 35,5) = 36,5g/mol e do H2S (2×1 +32) = 34g/mol
2 . (36,5) g ———– 34 g
219 g ———- x
73 x = 34 . 219
x = 102 g
Agora teste de vez seus conhecimentos com esse exercício sem minha resolução:
3) (Vunesp) Industrialmente tem-se o seguinte conjunto de reações para produção de ácido nítrico:
2 NH3 + 2O2 → 2 NO + 2 H2O + H2
2 NO + O2 → 2 NO2
3 NO2 + H2O → 2 HNO3 + 2 NO
Determinar a massa da amônia necessária para que ocorra a preparação de 378 gramas de ácido nítrico.
Dados: massas molares em g/mol: N= 14; H =1; O =16
Resposta: x = 153 g