Autoionização da água
A água possui papéis importantes em nosso cotidiano, dentre eles está sua participação química em soluções. Entenda nessa aula o processo de autoionização e venha estudar conosco para a prova do Enem!
O que é a autoionização da água?
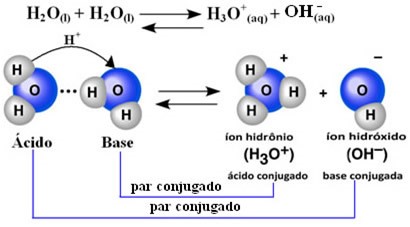
Antes de surtarmos nesse nome meio esquisito, é importante entender que a autoionização da água é uma reação química. Nela, duas moléculas de água reagem, produzindo um hidrônio H3O+ e um hidróxido OH–. A reação que ocorre é essa aqui:
H2O(l) + H2O(l) ↔ H3O+(aq) + OH–(aq)
Nesse processo de autoionização, uma molécula de água age como ácido doando um próton (H+); e outra molécula age como base, recebendo o próton, caracterizando a natureza anfótera da água.
Ou seja, a água tem essa capacidade de se comportar como um ácido ou como uma base, dependendo do meio em que ela esteja. Essa propriedade também significa que a água conduz corrente elétrica, pois ela possui íons.
A água é um eletrólito muito fraco, com valores baixos de grau de ionização e de constante de ionização no equilíbrio (Kc). É por isso que a água possui baixa condutividade elétrica.
Atenção! A água pura possui baixa condutividade elétrica, porém quando existe algum tipo de impureza na sua composição (como por exemplo alguns sais), seu grau de condutibilidade aumenta.
Na temperatura ambiente de 25ºC, é possível determinar que as concentrações de íons hidróxido e hidrônio produzidos na autoionização da água pura são iguais a 1 x 10-7 mol/L. É um valor muito pequeno, o que indica que o equilíbrio encontra-se muito deslocado para o sentido inverso (à direita), para a formação das moléculas de água e consumo dos íons, o que também explica a baixa condutividade elétrica da água.
[H+] = [OH–] = 10-7 mol/L.
Constante de equilíbrio iônico da água (Kw)
Podemos também estabelecer a constante do equilíbrio iônico da água, que é chamada de constante de dissociação da água ou produto iônico da água. É representada por Kw, sendo que a letra w se refere à palavra water, que em inglês significa água.
Como as outras constantes de equilíbrio, o Kw só se altera com a mudança de temperatura. À medida que a temperatura da água aumenta, a sua ionização também cresce, o que significa que a autoionização da água é um processo endotérmico, isto é, que absorve calor.
Kw = [H3O+] . [OH–]
Kw = [10-7]. [10-7]
Kw = 10-14
Como falamos lá em cima, a água pura não é uma boa condutora de eletricidade. Isso se deve ao fato da concentração dos íons H+ (10-7) ser igual a concentração dos íons OH– (10-7).
Porém, quando uma substância é adicionada à água podem acontecer alterações, afetando o equilíbrio iônico. Além da adição de sais, a adição de uma substância ácida ao sistema neutro, por exemplo, provoca o aumento da concentração dos íons H+, formando uma solução ácida e, diminuindo a concentração dos íons OH–.
Isso faz com que o equilíbrio da autoionização da água se desloque no sentido da reação inversa, diminuindo a concentração de íons OH–.
[H3O+] > [OH–]
[H+] > [OH–]
Já a adição de uma base à água ocorre o aumento da concentração de íons hidróxido OH–, o que faz com que o equilíbrio da autoionização da água se desloque no sentido da reação inversa, diminuindo a concentração de íons hidrônio (H3O+).
[H3O+] < [OH–]
[H+] < [OH–]
Uma solução é considerada neutra se a concentração em quantidade de matéria de íons hidrônio (H3O+) é igual à concentração em quantidade de matéria de íons hidróxido (OH–)
[H3O+] = [OH–]
[H+] = [OH–]
Concentrações de H+ e OH–
A concentração molar dos íons H+ e OH– de uma solução geralmente são potências de dez em expoente negativo. O químico dinamarquês Peter Lauritz Sorensen (1868-1939) em seus estudos sobre fermentação em processos biológicos trabalhava conceitos de acidez e basicidade. Os valores nos meios ácidos e básicos são pequenos em termos de concentração.
Ele propôs uma forma para transformar esses números pequenos em números inteiros e positivos, através do uso de logaritmos. Assim, ele criou o conceito de pH (potencial hidrogeniônico) e pOH (potencial hidroxiliônico).
O potencial hidrogeniônico (pH) representa o logaritmo negativo da concentração molar de íons H+:
pH = -log [H+]
Os valores de pH compreendem uma faixa de 0 a 14 unidades. Quando a solução possui um valor de pH entre 0 e 7, será uma solução ácida. Se o valor de pH estiver entre 7 e 14, a solução é considerada básica. Quando o pH for igual a 7, trata-se de uma solução neutra.
Exemplos de algumas substâncias ácidas: vinho (pH = 3,8), suco de laranja (pH = 3,0), vinagre (pH = 2,8).
O potencial hidroxiliônico representa o logaritmo negativo da concentração molar de íons OH-.
pOH = – log [OH-]
Quando o valor do pOH for maior que 0 e menor que 7, significa que o meio em questão é básico. Se o valor do pOH for maior que 7, significa que o meio é ácido. E se o pOH for igual a 7, o meio é neutro.
Exemplos de substâncias básicas: água do mar (pH = 8,9), leite de magnésia (pH = 10,0), saliva (pH = 7,2).
Numa solução básica, pH > pOH. A 25ºC: pH > 7 e pOH < 7.
Em todos os casos, a 25ºC, vale a relação:
pH + pOH = 14
A escala de pH é uma escala numérica usada para especificar a acidez ou basicidade de uma solução aquosa. As medições de pH são importantes na agronomia, agricultura, medicina, química, biologia, oceanografia, tratamento e purificação da água, etc.

Os indicadores são espécies que apresentam cores diferentes conforme o pH do meio em que se encontram. Se pretendemos entender se um meio é básico ou ácido, preparamos soluções dos indicadores para serem gotejadas na substância.
Como exemplo temos a fenolftaleína: se adicionar solução de fenolftaleína em um meio ácido ou neutro, ela se mantém incolor. Sua cor se altera a partir de pH = 8,2, ou seja, em meios básicos, ficando com coloração rosa.
O repolho roxo é outro exemplo de indicador, considerado universal, pois trabalha nos 3 meios. Uma solução ácida adquire a cor vermelha, a solução básica adquire a cor verde e a solução neutra, adquire a cor roxa.
Temos como indicadores também o papel de tornassol, alaranjado de metila,etc. Usa-se também o peagâmetro, que é um aparelho que detecta o pH de substâncias por meio de condutibilidade elétrica.
Resumo sobre autoionização da água
Estude mais sobre a autoionização da água com a aula abaixo!
Exercícios sobre autoionização da água
Agora vamos fazer alguns exercícios para testar os seus conhecimentos?
1) (UFRJ-RJ) Em um potenciômetro, se faz a leitura de uma solução 0,001M de NaOH (usado na neutralização do ácido láctico). Sabendo-se que o grau de dissociação é total, o valor de pH encontrado corresponde a:
a) 2,7
b) 5,4
c) 12,0
d) 11,0
e) 9,6
gab.: D
2) (VUNESP-SP) As leis de proteção ao meio ambiente proíbem que as indústrias lancem nos rios efluentes com pH menor que 5 ou superior a 8. Os efluentes das indústrias I, II e III apresentam as seguintes concentrações (em mol/L) de H+ ou OH–:
| indústria: | concentração no efluente: |
| I | [H+] = 10–³ mol/L |
| II | [OH-] = 10-5 mol/L |
| III | [OH-] = 10-8 mol/L |
Considerando apenas a restrição referente ao pH, podem ser lançados em rios, sem tratamentos prévios, os efluentes:
a) da indústria I, somente
b) da indústria II, somente
c) da indústria III, somente
d) das indústrias I e II, somente
e) das indústrias I, II e III
gab.: C
3) (PUC-SP) Calcular o pH de uma solução 0,2M de ácido acético (HAc), sabendo que, nessa diluição, o grau de ionização é igual a 0,5%:
a) 2
b) 5,5
c) 3
d) 4
e) 6
gab.: C





