Ligações químicas: o que são, tipos e exercícios resolvidos
Ligações químicas são as interações feitas entre os átomos no sentido de buscar maior estabilidade na camada eletrônica. Os tipos de ligações químicas são as ligações iônicas, covalentes e metálicas.
Porque os átomos realizam ligações?
O que são ligações químicas
Ligações químicas são as interações realizadas pelos átomos para adquirirem maior estabilidade. Segundo a Regra do Octeto, criada por Gilbert Newton Lewis, químico estadunidense, e Walter Kossel, físico alemão, um átomo adquire estabilidade quando possui 8 elétrons na camada de valência (camada eletrônica mais externa), ou 2 elétrons quando possui apenas uma camada. Para tanto, o átomo procura sua estabilidade doando ou compartilhando elétrons com outros átomos, donde surgem as ligações químicas.
Tipos de ligações químicas
Agora que você já aprendeu o que são ligações químicas e porque os átomos se ligam, vamos ver quais tipos de ligações eles realizam?
Ligações iônicas
É o tipo de ligação que se dá por meio da atração de íons de cargas opostas. Em uma ligação iônica, em geral há um átomo que tende a ceder elétrons (metal), constituindo o cátion, e outro que tende a receber os elétrons (não metal), ânion.
Veja o caso do cloreto de sódio:
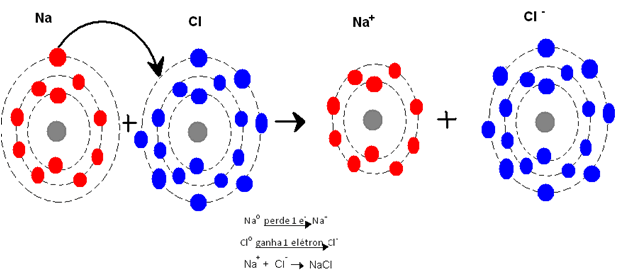
Para que o sódio (Na) atinja a sua estabilidade, ou seja, tenha 8 elétrons na última camada, é necessário que perca seu último elétron. Para que o mesmo aconteça com o cloro (Cl), é preciso que ele aumente em 1 seu número de elétrons da última camada, ou seja, ganhe 1 elétron. Quando isso acontece forma-se os íon, pois o número de elétrons desses elementos fica diferente do número de prótons. Portanto, na ligação iônica temos sempre uma transferência de elétrons.
Podemos indicar o processo que origina a ligação iônica usando a notação de Lewis:
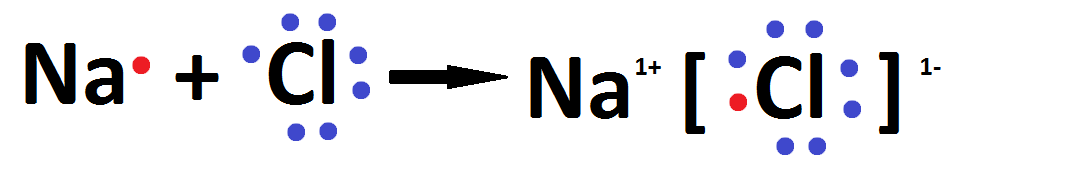
O cloreto de sódio também pode ser representado por sua fórmula iônica:
Na+ Cl–
Após a ligação, os elementos químicos são os mesmo e, portanto, os mesmos símbolos, já que não houve alteração de seu núcleo atômico.
Características dos compostos iônicos
A ligação iônica é de natureza elétrica, onde os íons positivos e negativos se atraem fortemente. Os compostos iônicos são sólidos na temperatura ambiente e possuem ponto de fusão e de ebulição elevados. Por isso, é preciso fornecer uma grande quantidade de energia para separar os íons e vencer a atração existente entre eles.
Além disso, os compostos iônicos são solúveis em água, e possuem elevada dureza. Ou seja, poucos materiais conseguem riscar os compostos iônicos. Conduzem corrente elétrica na fase líquida ou em solução aquosa, quando os íons estão livres; na fase sólida não conduzem corrente elétrica, pois não há íons soltos livres.
A fórmula eletrônica representa o número de elétrons na camada de valência dos átomos.
Exercício resolvido sobre ligações iônicas
Vamos fazer resolver um exercício para entender de vez as ligações iônicas e como elas podem cair no Enem?
(UFRJ-RJ-2009) Os átomos X e Y apresentam configurações eletrônicas: 1s2 2s² 2p6 3s1 e 1s² 2s² 2p5, respectivamente. Entre esses átomos forma-se um composto:
- a) iônico, de fórmula XY2
- b) molecular, de fórmula X2Y
- c) molecular, de fórmula XY2
- d) iônico, de fórmula XY4
- e) iônico, de fórmula XY
Resolução: o átomo X pertence ao grupo IA, portanto é um metal, e necessita perder 1 elétron para ficar estabilizado. O átomo Y pertence ao grupo VIIA, e é um ametal, e necessita ganhar 1 elétron para se estabilizar. A ligação é iônica, formando um composto iônico. Portanto, o gabarito da questão é a letra E.
Ligação covalente ou molecular
É a ligação que se dá por compartilhamento de par de elétrons, os elétrons da ligação passam a pertencer aos dois átomos ligados. Quando dois átomos estão unidos por uma ligação covalente, são chamados de molécula.
Vamos ver um exemplo de como ocorre uma ligação covalente.
O gás cloro é uma substância simples formada pelo elemento cloro, do grupo 17.
Na ligação entre dois átomos de cloro, ambos precisam de 1 elétron para se estabilizar, forma-se um par de elétrons para o qual cada um dos átomos de cloro fornece um elétron, que passa a ser compartilhado pelos dois átomos.
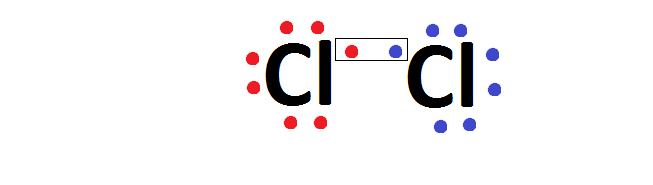
Após a ligação, o par de elétrons, passa a pertencer aos dois átomos, que, então, passam a ter 8 elétrons cada um no último nível. O conjunto formado passa a ser a molécula de cloro e é eletricamente neutra, isto é, não possui cargas positivas ou negativas e como não houve transferência de elétrons, não há íons.
Além da formula de Lewis, usamos a fórmula estrutural, em que cada par eletrônico comum é representado por um traço (-), e a fórmula molecular, no qual o símbolo é acompanhado do número de átomos que participa da molécula.

Resumo sobre ligações iônicas e covalentes
- Metais com Não-Metais = Ligação Iônica.
- Não-Metais com Não-Metais = Ligação Covalente.
- Ligação Iônica = Transferência definitiva de elétrons, formação de íons.
- Ligação Covalente = Compartilhamento do par de elétrons.
Ligações metálicas
A ligação metálica ocorre entre metais formando as ligas metálicas, que representam a união de dois ou mais metais. Os átomos de metais possuem poucos elétrons na camada eletrônica mais externa, que está afastada do seu núcleo atômico, pois eles são eletropositivos (têm tendência a perder esses elétrons), e é isso que ocorre, ficando esses elétrons livres.
Os átomos que perdem elétrons transformam-se em cátions, e os elétrons ficam se movimentando na estrutura e serão atraídos pelos cátions. Os átomos de metais se unem formando retículos cristalinos. Cada retículo é formado por milhares de átomos e serve para explicar a propriedade de maleabilidade, que é a capacidade de reduzir os metais a chapas e lâminas finas, e a ductilidade, que é a capacidade de transformar os metais em fios.
Os metais são formados por aglomerados de átomos neutros e cátions, que ficam rodeados por uma nuvem ou mar de elétrons, que funciona como a ligação metálica, que irá manter os átomos de metal unidos.

Ligas metálicas
As ligas metálicas são resultado da união de metais entre si ou de metal com outra substância. Podemos citar exemplos de ligas metálicas:
- aço: liga de ferro e carbono
- aço inoxidável: liga de ferro, carbono, cromo e níquel
- latão: liga de bronze e cobre
- bronze: liga de cobre e estanho
Videoaula sobre ligações químicas
Para terminar sua revisão sobre ligações químicas, assista à videoaula abaixo, gravada pelo professor Felipe Sobis para o canal do Curso Enem Gratuito!
Exercício resolvido
(Mack) Na ligação entre átomos dos elementos químicos 15P31 e Ca, que tem 20 prótons, forma-se o composto de fórmula:
a)CaP
b)Ca3P
c)CaP3
d)Ca2P3
e) Ca3P2
Resolução
A primeira coisa que você deve fazer é a distribuição eletrônica para os átomos de P e Ca, veja abaixo como fica.
15P: 1s2 2s2 2p6 3s2 3p3
20Ca: 1s2 2s2 2p6 3s2 3p6 4s2
O P possui 5 elétrons na camada de valência (em vermelho), sendo assim para atingir o octeto completo precisa ganhar três elétrons. Já o Ca possui 2 elétrons na camada de valência, então pode doar dois elétrons para atingir o octeto completo (camada anterior). Para formar o composto entre esses dois elementos químicos, o número de elétron perdido e ganho tem que ser o mesmo, desta maneira temos que ter dois átomos de P e três de Ca,
1 átomo de P ganha três elétrons-> 2 átomo de P ganham seis elétrons;
1 átomo de Ca perde dois elétrons – > 3 átomos de Ca perdem seis elétrons;
assim temos o balanço de carga e a alternativa que contém o composto correto é a letra e ( Ca3P2).
Exercícios sobre ligações químicas
Agora é a sua vez! Resolva os exercícios sobre ligações químicas abaixo para fixar bem o conhecimento adquirido nesta aula!
.