Você sabia que quando misturamos um ácido e uma base em uma certa reação química, estas substâncias irão reagir entre si, e uma delas irá neutralizar a outra? Então venha estudar conosco e aumentar seus conhecimentos para a prova do Enem!
Segundo a Teoria de Arrhenius, o ácido é a substância que libera o cátion hidrogênio (H+) em meio aquoso. Já a base é a substância que libera o ânion hidroxila (OH–) em meio aquoso. Na reação entre essas duas substâncias, formam-se sal e água (reação de neutralização).
O que é a reação de neutralização
A reação entre um ácido e uma base é chamada de reação de neutralização ou reação de salificação, pois o produto formado é um sal. Outra característica das reações de neutralização é justamente a neutralização do pH do meio.
Exemplos do dia-a-dia
Antes de vermos como funcionam as reações de neutralização total e parcial, é interessante entender onde as reações de salificação ocorrem no nosso dia a dia. A mais famosa com certeza é a formação do sal de cozinha, o NaCl (que veremos logo abaixo). Mas também temos outras reações importantes como o controle da azia no nosso corpo.
O nosso processo digestivo utiliza HCl (ácido clorídrico) para acontecer. Quando temos um excesso desse ácido no processo, sentimos seu efeito: enjoo, náuseas, etc. Sabemos que para neutralizar a ação de um ácido, precisamos de uma base. É por isso que quando apresentamos um quadro de azia, podemos procurar fármacos que utilizem bases em sua composição.
Uma das bases mais utilizadas em antiácidos estomacais é o Hidróxido de Magnésio, o Mg(OH)2. Mas, cuidado! Lembre-se sempre de não se auto medicar e buscar ajuda médica quando sentir-se mal.
Reação de neutralização total
A neutralização total ocorre quando todos os íons H+ provenientes do ácido são consumidos pelos íons OH– (hidroxila) provenientes da base, para formar como produto a água. Os cátions (cargas positivas) deixadas pelas bases se ligam aos ânions (cargas negativas) provenientes dos ácidos para formar os sais, que neste caso são denominados neutros ou comuns.
Ácido + base → sal + água
H+X– Y+OH– XY HOH
Vamos observar alguns exemplos de reações bem conhecidas e que costumam aparecer no Enem e vestibulares:
HCL + NaOH → NaCl + H2O
H2SO4 + Ca(OH)2 → CaSO4 + 2 H2O
2 H3PO4 + 3 Mg(OH)2 → Mg3(PO4)2 + 6 H2O
4 NH4OH + H4SiO4 → (NH4)4SiO4 + 4 H2O
Observe que em todos os exemplos os íon H+ e OH– foram utilizados para formar as moléculas de água. Observe também que devemos verificar o balanceamento da reação química para que ela fique correta.
Reações de neutralização parcial
Nas reações de neutralização parcial, há o consumo de uma parte do ácido ou da base, sobrando na reação íons H+ ou OH–, sem serem neutralizados. Os íons que não foram neutralizados estarão presentes na fórmula do sal formado.
A reação de neutralização parcial pode ser:
Reação de neutralização parcial do ácido
As hidroxilas (OH–) da base não são suficientes para consumirem todos os íons H+ do ácido, assim, o ácido estará em maior quantidade em relação a base.
Exemplo: H2CO3 + NaOH → NaHCO3 + H2O
Observe que:
1) H2CO3 é um diácido (possui 2 H+ ionizáveis)
2) NaOH é uma monobase (possui apenas uma hidroxila). Neste caso, somente um H+ será neutralizado por outro íon OH–, sobrando um íon H+ na reação. Este íon H+ será incorporado na fórmula do sal obtido. Este sal formado é classificado como hidrogeno-sal ou sal ácido.
Reação de neutralização parcial da base:
Os íons H+ não são suficientes para neutralizar todas as hidroxilas (OH–) da base, assim, a base estará em maior quantidade em relação ao ácido.
Exemplo: HCl + Ca(OH)2 → Ca(OH)Cl + H2O
Observe que:
1) HCl é monoácido (possui apenas 1 H+ ionizável)
2) Ca(OH)2 é uma dibase (possui 2 hidroxilas). Neste caso, um íon H+ será neutralizado por um íon OH–, formando apenas uma molécula de água. O outro íon OH– será incorporado à fórmula do sal. Este sal é denominado de hidroxi-sal ou sal básico.
Videoaula
Para continuar estudando as reações de neutralização, assista à videoaula abaixo, em que o professor Sobis, de Química, explica como elas acontecem!
Exercícios
Agora vamos testar nossos conhecimentos sobre sais com reação de neutralização e fazer alguns exercícios?
Sumário do Quiz
0 de 10 questões completadas
Perguntas:
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
Information
.
Você já fez este questionário anteriormente. Portanto, não pode fazê-lo novamente.
Quiz is loading...
You must sign in or sign up to start the quiz.
Para iniciar este questionário, você precisa terminar, antes, este questionário:
Resultados
0 de 10 perguntas respondidas corretamente
Seu tempo:
Acabou o tempo
Você conseguiu 0 de 0 pontos possíveis (0)
| Pontuação média |
|
| Sua pontuação |
|
Categorias
- Sem categoria 0%
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- Respondido
- Revisão
-
Pergunta 1 de 10
1. Pergunta
(FATEC SP/2019)
Uma das substâncias que pode neutralizar o ácido fosfórico é o hidróxido de magnésio, Mg(OH)2.
A equação química balanceada que representa a reação de neutralização total que ocorre entre essas substâncias éCorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 2 de 10
2. Pergunta
(Mackenzie SP/2019)
As reações entre ácidos e bases produzem sal e água e são classificadas como reações de neutralização, que pode ser parcial ou total. Abaixo estão representadas três equações incompletas entre um ácido e uma base.
I. H3PO4 + KOH
II. HNO3 + Ca(OH)2
III. H2SO4 + NaOHSendo assim, as fórmulas químicas dos sais obtidos, sob condições ideais de reação, a partir da neutralização entre iguais quantidades em mols de cada uma das espécies representadas nas equações acima, são, respectivamente,
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 3 de 10
3. Pergunta
(UFU MG/2018)

Disponível em: <http://2.bp.blogspot.com/>.
Acesso em 10 de março de 2018Na charge são lidas algumas substâncias que aparecem no “leite de caixinha”, substâncias essas adicionadas com funções distintas na preservação e na conservação do produto.
As substâncias citadas na charge
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 4 de 10
4. Pergunta
(UNIRG TO/2016)
O Mg(OH)2 pode ser usado para neutralizar excesso de HCl presente no suco gástrico. Considerando a equação balanceada com os menores coeficientes inteiros possíveis para essa reação, são feitas as seguintes afirmações:
I. O valor da soma dos coeficientes dos reagentes dessa reação é igual a 3.
II. Um dos produtos formados a partir dessa reação é o sal cloreto de magnésio.
III. Ocorre uma reação de neutralização envolvendo uma base fraca e um ácido fraco.
IV. Considerando reação completa, pode-se dizer 3,65g de ácido clorídrico reagem com 5,8 g de hidróxido de magnésio.Assinale a única alternativa que apresenta todos os itens corretos:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 5 de 10
5. Pergunta
(UNISC RS/2015)
As fórmulas corretas de ácido e da base que, por neutralização, produzem FePO4, além de água, são, respectivamente,
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 6 de 10
6. Pergunta
(FATEC SP/2014)
Considere a tabela que apresenta os pontos de fusão (PF) e de ebulição (PE), a 25°C e 1 atm
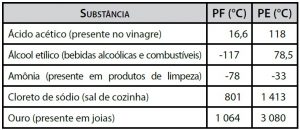
(http://www.alunosonline.com.br/quimica/ponto-fusao-ponto-ebulicao.html
Acesso em: 14.02.2014)A reação que ocorre para a formação do sal presente na tabela é
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 7 de 10
7. Pergunta
(UERN/2013)
O ácido sulfúrico, comumente encontrado nas baterias de carro, reage com o hidróxido de sódio, conhecido como soda cáustica, na proporção de 1:1. O precipitado formado será o
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 8 de 10
8. Pergunta
(UFTM MG/2011)
O ácido fosfórico, estrutura química representada na figura, é utilizado na indústria de fertilizantes e de bebidas. Seu uso vem aumentando devido à expansão da produção agrícola e é comercializado como solução aquosa concentrada com teor de 85% em massa e densidade 1,7 g.mL–1, a 20 ºC.

Na equação completa da reação de neutralização total do ácido fosfórico com hidróxido de potássio (KOH), a somatória dos índices estequiométricos é igual a
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 9 de 10
9. Pergunta
(PUC RJ/2010)
De acordo com a teoria de Arrhenius, ácido é a substância que, em meio aquoso, libera íons H+, e base é a substância que, em meio aquoso, libera íons OH–.
A reação de um ácido com uma base é conhecida como “reação de neutralização” por causa da neutralização da espécie H+ pela espécie OH–, ou vice-versa, formando água no estado líquido. Esse fenômeno pode ser representado de maneira simplificada pela equação
H+(aq) + OH–(aq) -> H2O(l)
Na reação de neutralização do hidróxido de sódio com ácido clorídrico em solução aquosa, os íons espectadores são:
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
-
Pergunta 10 de 10
10. Pergunta
(UDESC SC/2010)
Assinale a alternativa que representa o gás liberado da reação entre ácido clorídrico e carbonato de sódio.
CorretoParabéns, resposta correta! Siga com o simulado.
IncorretoA resposta está incorreta. Veja uma revisão nesta aula e continue se preparando para o Enem e vestibulares!
Sobre o(a) autor(a):
Texto elaborado por Roseli Prieto, professora de Química e Biologia da rede estadual de São Paulo. Já atuou em diversas escolas públicas e privadas de Santos (SP). É Gestora Ambiental e Especialista em Planejamento e Gestora de cursos a distância.

