Compostos covalentes: propriedades, o que são e exemplos
A grande maioria dos átomos necessita se estabilizar, seja no núcleo, onde ocorre a radioatividade, ou na eletrosfera, onde ele realiza ligação química. Para isso, depende dos átomos que irão se ligar. E para que esse processo ocorra, os átomos se mantêm unidos por meio de forças denominadas intramoleculares, formando as moléculas ou compostos.
Hoje vamos estudar as propriedades dos compostos covalentes, entender por que elas são importantes e suas principais características. Então fique conosco e se prepare para a prova do Enem!
Para entendermos as propriedades dos compostos covalentes, precisamos relembrar as ligações iônicas e as covalentes. Vamos lá?
Ligações iônicas e covalentes
A ligação iônica ocorre entre um metal, que tem a capacidade de doar elétrons, e um ametal, que tem a capacidade de receber elétrons. Essa ligação gera uma atração eletrostática muito forte entre os elementos.
A ligação iônica se caracteriza pela transferência de elétrons, formando cargas positivas e negativas, sendo muito difícil separar essas partículas. As características principais dos compostos iônicos são: altos pontos de fusão e de ebulição, além de serem compostos sólidos.
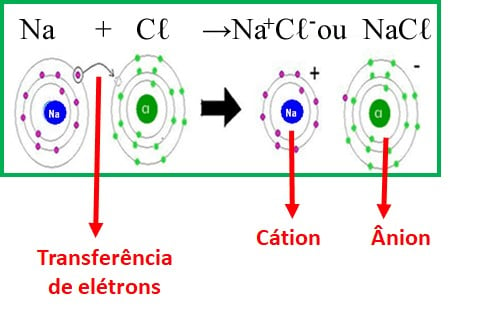
Já a ligação covalente ocorre entre átomos de ametais, semimetais e também o hidrogênio, onde eles apresentam a capacidade de receber elétrons.
Diferenças entre Ligação Iônica e Ligação Covalente
Veja agora com a professora Larissa Campos, do canal do Curso Enem Gratuito, o resumo inicial para você dominar Ligação Covalente:
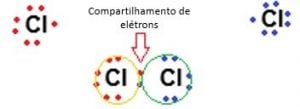
Na ligação covalente não há um deslocamento de elétrons e nem formação de íons, como vimos na ligação iônica. Aqui, ela ocorre por meio do compartilhamento de pares de elétrons entre átomos, formando um conjunto de moléculas.
A ligação covalente é considerada mais fraca que a ligação iônica, devido à baixa atração entre seus átomos, sendo fácil separar os compostos.
Propriedades dos compostos covalentes
Os compostos covalentes, formados por ligações covalentes, podem ser encontrados nos três estados físicos: sólido, líquido e gasoso. No estado sólido, temos como exemplo a molécula de açúcar (sacarose): C12H22O11.
No estado líquido temos a molécula da água (H2O) e no estado gasoso podemos trazer três exemplos bastante conhecidos: CO2, N2 e O2.
Os compostos covalentes não apresentam íons livres, e como consequência disso temos uma das suas principais características: eles não conduzem corrente elétrica. Por isso, são conhecidos como isolantes elétricos.
Porém, temos como exceção a grafita, que conduz corrente elétrica no estado sólido, além de alguns compostos covalentes que, quando dissolvidos em água, produzem íons livres.
Esse processo é conhecido como ionização, e dessa forma, geram uma solução condutora de corrente elétrica.
Os ácidos são exemplos de compostos covalentes que sofrem ionização. Ou seja, liberam íons quando dissolvidos em água, e assim, conduzem corrente elétrica.
Como exemplo podemos citar o ácido clorídrico (HCl):
HCl → H(aq)+ + Cl(aq)–
O HCl forma os íons H+ e Cl–.
Polaridade dos compostos covalentes
A polaridade (formação de polos pelo deslocamento das nuvens eletrônicas) interfere na característica das moléculas, assim, podemos ter compostos covalentes tanto polares quanto apolares.
O que define a polaridade de um composto covalente é a diferença de eletronegatividade entre seus átomos.
A eletronegatividade é a capacidade do átomo em atrair elétrons em uma ligação, formando polos na molécula.
Em uma molécula, uma diferença de eletronegatividade significa que: o átomo que apresenta maior eletronegatividade terá um polo negativo, já o átomo que apresenta menor eletronegatividade terá um pilo positivo.
Os compostos covalentes apolares não apresentam diferença de eletronegatividade entre os átomos.
Já os compostos covalentes polares possuem diferença de eletronegatividade entre os átomos.
Os compostos covalentes polares se dissolvem em solventes polares e os compostos covalentes apolares se dissolvem em solventes apolares.
Vamos ver através dos exemplos: o álcool etílico (polar) se solubiliza em água (polar); o querosene é apolar e se solubiliza na gasolina (apolar). Além desses, temos um dos mais famosos: a água e a gasolina não se dissolvem (misturam), devido a sua diferença de polaridade.
Ponto de fusão e ebulição dos compostos covalentes
O ponto de fusão e de ebulição dos compostos covalentes é menor que o ponto de fusão e de ebulição dos compostos iônicos, porque as moléculas dos compostos covalentes possuem baixa atração entre si. Assim, a energia necessária para separar essas moléculas e mudar o seu estado físico é muito baixa.
Outra propriedade dos compostos covalentes é a dureza (resistência que um material oferece ao ser riscado por outro material), sendo o diamante o material mais duro.
A propriedade tenacidade, representa a resistência ao choque e geralmente os compostos covalentes são frágeis e quebradiços.
Videoaula
Aprenda mais sobre os compostos moleculares e covalentes nesta videoaula de Química!
Exercícios
1) (UEL-PR)
É previsível que compostos gasosos constituídos por moléculas polares (com dipolos permanentes), em condições ambientes, sejam:
I) Facilmente liquefeitos por aumento de pressão e abaixamento de temperatura.
II) Bons condutores de corrente elétrica.
III) Formados por um único elemento químico.
Dessas afirmações, apenas
a) I é correta.
b) II é correta.
c) III é correta.
d) I e II são corretas.
e) II e III são corretas.
gabarito: A
2) (UFF-RJ)
O leite materno é um alimento rico em substâncias orgânicas, tais como proteínas, gorduras, açúcares, e substâncias minerais como, por exemplo, o fosfato de cálcio. Esses compostos orgânicos têm como característica principal as ligações covalentes na formação de suas moléculas, enquanto o mineral apresenta também ligação iônica.
Assinale a alternativa que apresenta corretamente os conceitos de ligação covalente e iônica:
a) a ligação covalente só ocorre nos compostos orgânicos
b) a ligação covalente se faz por transferência de elétrons, e a ligação iônica pelo compartilhamento de elétrons com spins opostos.
c) a ligação covalente se faz por atração de cargas entre átomos e a ligação iônica por separação de cargas.
d) a ligação covalente se faz por união de átomos em moléculas e a ligação iônica por união de átomos em complexos químicos.
e) a ligação covalente se faz pelo compartilhamento de elétrons e a ligação iônica por transferência de elétrons.
gabarito: E
3) (UFES)
As ligações químicas predominantes entre os átomos dos compostos: HI, NH3, NaCl são:
a) iônica, covalente, iônica
b) covalente, iônica, iônica
c) iônica, covalente, covalente
d) covalente, covalente, iônica
e) iônica, iônica, covalente
gabarito: D
4) (UFPE-PE)
Um composto iônico é um composto químico no qual existem íons ligados através de ligações iônicas formando uma estrutura cristalina. Os íons que entram na composição de um composto iônico podem ser simples espécies químicas, como ocorre no NaCl ou grupos mais complexos como ocorre no Ca²+CO3²-(carbonato de cálcio). Dentre os compostos a seguir, qual não é um composto iônico:
a) LiF
b) KCl
c) CO
d) CsCl
e) NaBr
gabarito: C





