Propriedades coligativas das soluções
É muito importante estudar as propriedades das substâncias para poder compreender como elas se comportam e como podemos utilizá-las em vários processos em nosso cotidiano. Revise Química para o Enem e vestibulares!
Quando temos uma solução, que representa uma mistura de duas ou mais substâncias de aspecto homogêneo, suas propriedades são diferentes das propriedades das substâncias iniciais. Chamamos de propriedades coligativas o estudo das propriedades físicas das soluções.
O que são propriedades coligativas
As propriedades coligativas são aquelas que observamos quando é adicionado um soluto não volátil (substância que não evapora com facilidade e que, às vezes, necessita de aquecimento para evaporar) a um solvente.
As partículas que ficam dispersas no solvente, que geralmente é a água, são as responsáveis pelas mudanças em certas propriedades do solvente. As propriedades coligativas das soluções dependem da quantidade de partículas, íons ou moléculas do soluto na solução. Elas também não dependem da natureza do soluto.
Tipos de solutos
Podemos observar a existência de dois tipos de solutos que podem ser adicionados ao solvente: o soluto molecular e o iônico. O soluto molecular é aquele que não possui íons em sua formação. Como exemplo, podemos misturar o açúcar (C12H22O11) na água e obter uma solução molecular na qual suas moléculas permanecem inteiras.
Ou seja, o número de partículas de soluto existentes na solução é igual ao número de moléculas que foram dissolvidas no solvente. Vamos ver montando a regra de três:
1 mol C12H22O11 (s) ————— 1 mol C12H22O11 (aq)
6,0 x 10²³ moléculas ————– 6,0 x 10²³ moléculas
Outro tipo de soluto é iônico, que é aquele que possui íons na sua composição e que sofre dissociação iônica, formando íons com cargas diferenciadas.
Como exemplo, podemos citar o sal de cozinha (NaCl) misturado à água. Seus íons serão separados pela atração com os polos da água.
NaCl (s) ——- Na+ (aq) + Cl- (aq)
1 mol NaCl (s) ——- 1 mol Na+ (aq) + 1 mol Cl- (aq)
6,0 x 10²³ ———— 6,0 x 10²³ íons + 6,0 x 10²³ íons
6,0 x 10²³ moléculas ——— 2. (6,0 x 10²³) íons
Assim, o número de partículas presentes na solução é duas vezes maior que o número de partículas que foram adicionadas à água.
Quando certos solutos são encontrados em algumas soluções, podem ocorrer modificações em suas propriedades coligativas. Essas modificações são denominadas tonoscopia, ebulioscopia, crioscopia e osmoscopia. Antes de vermos cada uma delas, é importante entender o que é a pressão máxima de vapor.
Pressão máxima de vapor
A pressão máxima de vapor é a pressão exercida pelo vapor quando está a uma temperatura em que atinge o equilíbrio com o líquido correspondente. Ou seja, é a maior pressão que os vapores de um líquido exercem em determinada temperatura.
Quando abrimos um frasco de perfume, o seu aroma logo se espalha pelo ambiente. Isso ocorre porque algumas moléculas se movimentam com mais velocidade e conseguem escapar do frasco. Lembrando que no estado gasoso, as moléculas se movimentam com mais velocidade do que no estado líquido.
Após certo tempo, a velocidade com que as moléculas evaporam se iguala à velocidade com que seus vapores se condensam, chegando a um estado de equilíbrio. Nesse momento, uma molécula de vapor passa para o estado líquido, e uma outra que está no estado líquido volta para o estado de vapor ao mesmo tempo, atingindo a pressão máxima de vapor. Quando há evaporação de um certo solvente, há o rompimento das ligações intermoleculares, fazendo o vapor sair da massa líquida.
A pressão de vapor indica a facilidade de uma substância mudar do estado físico líquido para vapor. Quanto maior sua pressão de vapor, maior a facilidade de evaporação do líquido. A pressão máxima de vapor está relacionada à temperatura e à natureza do reagente.
Quanto maior for a temperatura, maior será a pressão de vapor. Isso porque a elevação da temperatura provoca a agitação das moléculas, aumentando o número de choques entre elas. Consequentemente, ocorre a quebra das forças intermoleculares, o que favorece a evaporação do líquido.
A pressão de vapor varia de uma substância para outra, pois quanto mais fortes forem as interações intermoleculares, mais difícil será para a molécula se desprender e passar para o estado de vapor. Quanto maior a força intermolecular, mais difícil é uma substância evaporar, pois suas moléculas estão mais próximas uma das outras.
Líquidos mais voláteis do que a água, como o álcool comum e o éter comum, evaporam mais intensamente, resultando em maiores pressões máximas de vapor à mesma temperatura.
As curvas desses líquidos estarão acima da curva de pressão máxima de vapor da água. Por esse motivo que o éter, que tem força intermolecular do tipo dipolo-permanente, tem pressão de vapor maior que a água, que possui força intermolecular do tipo pontes de hidrogênio.
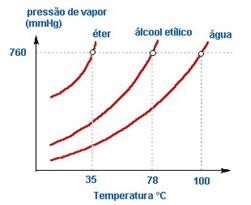
Quanto menor for o ponto de ebulição do solvente, maior será a pressão máxima de vapor. E, quanto maior a quantidade de partículas em uma solução, menor será a sua pressão de vapor.
No gráfico abaixo, temos no eixo y a pressão máxima de vapor, e no eixo x a temperatura. Veja as três curvas de líquidos diferentes:
Pelo gráfico observamos que quanto mais próximo do eixo y, maior a pressão de vapor e menor o ponto de ebulição. Dos solventes do gráfico, o que apresenta maior pressão máxima de vapor é o éter.
Modificações nas propriedades coligativas
Agora que já passamos pela pressão máxima de vapor, vamos voltar aos quatro tipos de modificações nas propriedades coligativas.
Tonoscopia
A tonoscopia representa a diminuição da pressão máxima de vapor do solvente. Isso acontece após a adição de um soluto não volátil à solução. Ao dissolver-se o soluto, o ponto de ebulição do solvente é elevado, impedindo a evaporação. Essas mudanças ocasionam a diminuição da pressão máxima de vapor.
Ebulioscopia
A ebulioscopia é a propriedade coligativa que ocasiona a elevação da temperatura de um líquido quando se adiciona a ele um soluto não volátil.
O soluto dificulta a evaporação do solvente. Assim, é preciso aumentar a temperatura para poder evaporar o solvente. A temperatura em que se inicia a ebulição do solvente em uma solução de soluto não-volátil é sempre maior que o ponto de ebulição do solvente puro.
Por exemplo, quando você cozinha macarrão e adiciona sal ou um pouco de óleo, você eleva o ponto de ebulição da água. Isso ocorre porque a interação entre as moléculas da água e do sal (ou do óleo) dificultam a mudança da molécula para o estado de vapor. Por isso, é preciso adicionar mais energia na forma de calor para que a solução entre em ebulição.
No processo de cozimento dos alimentos, o principal interesse é que se atinja uma temperatura maior a fim de se reduzir o tempo de cozimento e não que se atinja o ponto de ebulição da água (caso contrário, ela irá evaporar).
Podemos citar também o uso da panela de pressão, em que os alimentos dentro estão com uma pressão maior que a pressão atmosférica. A água não entra em ebulição em 100ºC, mas sim em temperaturas mais elevadas, o que faz com que o alimento cozinhe mais rápido. A válvula com pino presente na panela de pressão libera o vapor em excesso, impedindo que a pressão faça a panela explodir.
Podemos observar alguns efeitos da ebulioscopia no nosso dia a dia:
1 – O ponto de ebulição da água do mar é maior do que a água doce por causa da concentração salina ser muito superior na água do mar do que na água doce.
2 – Gastamos mais tempo para aquecer uma mistura de água com temperos do que para aquecer a água pura quando se cozinha em panela aberta.
3 – A temperatura de uma solução aquosa (solvente é a água) será sempre superior à temperatura de ebulição da água pura, ou seja, sempre superior à 100ºC (quando ao nível do mar).
Crioscopia
A crioscopia representa a propriedade coligativa que ocasiona a diminuição na temperatura de congelamento do solvente, provocada pela adição de um soluto não volátil.
A água pura sempre irá congelar mais rápido do que se for adicionado algum soluto formando uma solução. As partículas dissolvidas interagem com as moléculas do solvente, dificultando a interação entre essas moléculas e fazendo com que o congelamento ocorra em uma temperatura menor.
Podemos observar alguns efeitos da crioscopia em nosso dia a dia como:
1 – Em países frios, com invernos rigorosos e muita neve, é comum jogar sal nas estradas para a neve derreter.
2 – A água do mar não se congela em locais próximos aos pólos, pois há uma grande quantidade de sais dissolvidos na água. Os icebergs e as camadas de gelo que se formam são compostas de água sem esses sais.
3 – Em países frios, é comum usar aditivos nos radiadores dos carros para diminuir o ponto de ebulição da água e evitar o seu congelamento.
4 – A água dos sorvetes e dos cosméticos (cremes) não congela, transforma-se em gelo puro, pois demora mais tempo para congelar. Isso ocorre porque essa água contém solutos não voláteis dissolvidos, causando a redução da temperatura de congelamento da água. A água pura congela a 0ºC, mas quando misturada com essas substâncias, ela passa a congelar a temperaturas abaixo de 0ºC.
Osmoscopia
A osmoscopia é a propriedade coligativa que estuda a difusão de um líquido para outro.
Para compreendê-la, é preciso lembrar como funciona a osmose, que é o processo que permite a passagem do solvente de uma solução diluída para uma solução mais concentrada (menos diluída).
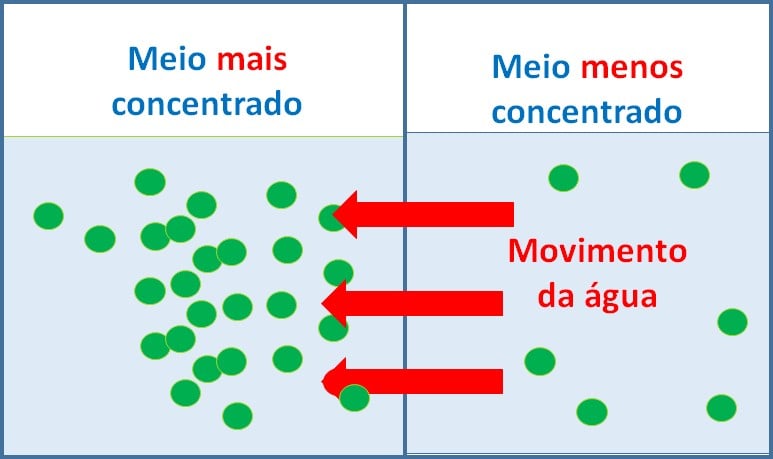
A osmose ocorre no sentido do meio hipotônico (baixa concentração de soluto) para o meio hipertônico(alta concentração de soluto) para diluir ou diminuir a concentração do meio hipertônico, e para que as concentrações se igualem e se tornem isotônicas. Quando as soluções se tornam isotônicas, a pressão osmótica se anula, ou seja, não há mais movimentação da água.
Podemos observar alguns efeitos da osmoscopia em nosso cotidiano como:
1 – Para conservar as carnes costuma-se salgá-las: o meio externo está mais concentrado por causa do sal, e o meio interno menos concentrado. Por isso, ocorre a saída de água das células, evitando a deterioração das carnes.
2 – Quando temperamos uma salada de alface: depois de algum tempo, as folhas murcham porque a água passa das células da alface (menos concentrado) para o meio mais concentrado, que é representado pelo vinagre e sal, para diluir a concentração de vinagre. Se colocarmos a alface na água, ocorre passagem de solvente do meio externo para dentro das células da alface, deixando a alface mais bonita.
2 – Frutas em compotas: compotas são caldas com grande concentração de açúcar. As frutas liberam água para a calda, aumentando seu tempo de conservação. Assim, os microorganismos não conseguem se desenvolver neste meio.
Vamos assistir um vídeo para aumentar nossos conhecimentos sobre propriedades coligativas?
Exercícios sobre propriedades coligativas
.





